
期刊:European Respiratory Journal
影响因子:16.6
主要技术:scRNA-seq;空间转录组;成纤维细胞
导语
组织纤维化是大多数主要慢性疾病中最大的未解决的临床问题之一,产生细胞外基质(ECM)的肌成纤维细胞是对抗组织纤维化的关键治疗靶点。单细胞RNA测序(scRNAseq)研究描述了小鼠和人肺中不同的胶原生成基质细胞亚群,揭示了它们在支持上皮修复方面具有不同的空间位置和不同的功能。但成纤维细胞异质性如何导致纤维化疾病尚不清楚。小鼠模型的遗传谱系追踪提供了肺损伤后肺泡脂肪成纤维细胞向肌成纤维细胞转换的证据,该转换在完成上皮再生后的短暂纤维化消退过程中是可逆的。肺纤维化中肌成纤维细胞细胞来源的异质性仍然是当前研究的主题。除了脂肪成纤维细胞外,肺泡周细胞也是肌成纤维细胞的潜在来源。肌成纤维细胞的增殖、逃避凋亡和侵袭能力是纤维化疾病的关键标志,大量文献证实TGFβ诱导成纤维细胞中α-平滑肌肌动蛋白(ACTA)2的表达,这是组织中最广泛使用的成熟肌成纤维细胞标志物。然而,纤维化组织和肌成纤维细胞病灶的定位和免疫荧光分析也表明,相当一部分成纤维细胞是ACTA2阴性,这表明在损伤激活的成纤维细胞中存在额外的分子复杂性和异质性。最近对肺纤维化中胶原生成细胞的单细胞分析显示,CTHRC1是高侵袭性ACTA2+肌成纤维细胞的特异性标志物。这些细胞存在于小鼠和人的肺中,并在特发性肺纤维化(IPF)中占据成纤维细胞灶。
本研究结合空间转录组学、多重免疫染色、单细胞测序和遗传谱系追踪揭示了不同成纤维细胞状态向CTHRC1+肌成纤维细胞的时空演化,强调了在肌成纤维细胞分化之前,损伤诱导的成纤维细胞激活的早期事件。我们发现了一种新的Sfrp1+ /ACTA2-过渡状态,它最初是非侵袭性的,只有在TGFβ驱动的向CTHRC1+肌成纤维细胞状态的分化时才具有侵袭性。我们发现Sfrp1调节TGFβ1诱导的成纤维细胞侵袭和RHOA通路活性,这构成了一个新的途径,具有靶向肌成纤维细胞介导的纤维化疾病的潜力。
技术服务
scRNA-seq;空间转录组;成纤维细胞
研究结果
1. 肺间充质细胞在肺部不同空间定位上的异质性
为了研究Tcf21+和Tcf21−成纤维细胞谱系的异质性,我们使用Tcf21m-Crem-R26R-tdTomato小鼠,在11周龄时肺中使用他莫昔芬标记Tcf21+细胞。对Tcf21 lin+和lin−基质细胞进行了流式分类,并进行了scRNAseq (n=4只小鼠,k=12.068个细胞),鉴定出6种具有不同Tcf21谱系比例的不同细胞类型(图1A)。所有细胞类型均表达1型胶原(Col1a2)。我们确定了三个主要的Pdgfra+群体(脂肪成纤维细胞、胞外基质成纤维细胞、Adh7+成纤维细胞),两个Pdgfrb+群体(平滑肌细胞和周细胞)具有高度不同的标记基因和途径富集(图1B和C),以及最近在肾脏中发现的Pdgfra/Pdgfrb双阳性细胞。这些细胞表达Lgr5和Lgr6(图1B),它们是细支气管周围成纤维细胞群的标记物。
接下来,我们使用靶向空间转录组学,沿着气道树的近端远端轴,在成年小鼠肺的六个代表性区域(n=2)中多重定位18个细胞类型标记基因的mRNA(图1D)。hip+/Aspn+细支气管周围成纤维细胞在气道周围富集,肺泡内也有部分细胞。Myh11+/Acta+平滑肌细胞和serinf1+/ cle3b+外层成纤维细胞在气道和大血管周围富集。Gucy1a3+/Postn+周细胞优先定位于肺泡间隙和大血管周围。Tcf21+/Npnt+脂肪成纤维细胞优先定位于肺泡间隙(图1E)。
因此,与Sftpc+ AT2细胞物理接近(直接细胞间接触)的细胞数量在周细胞和脂肪成纤维细胞中最高,一些hip+/Aspn+细胞也参与AT2细胞生态位(图1F)。我们的数据强调了AT2细胞生态位的复杂性,在这里证明了它至少包含三种不同的基质细胞类型。
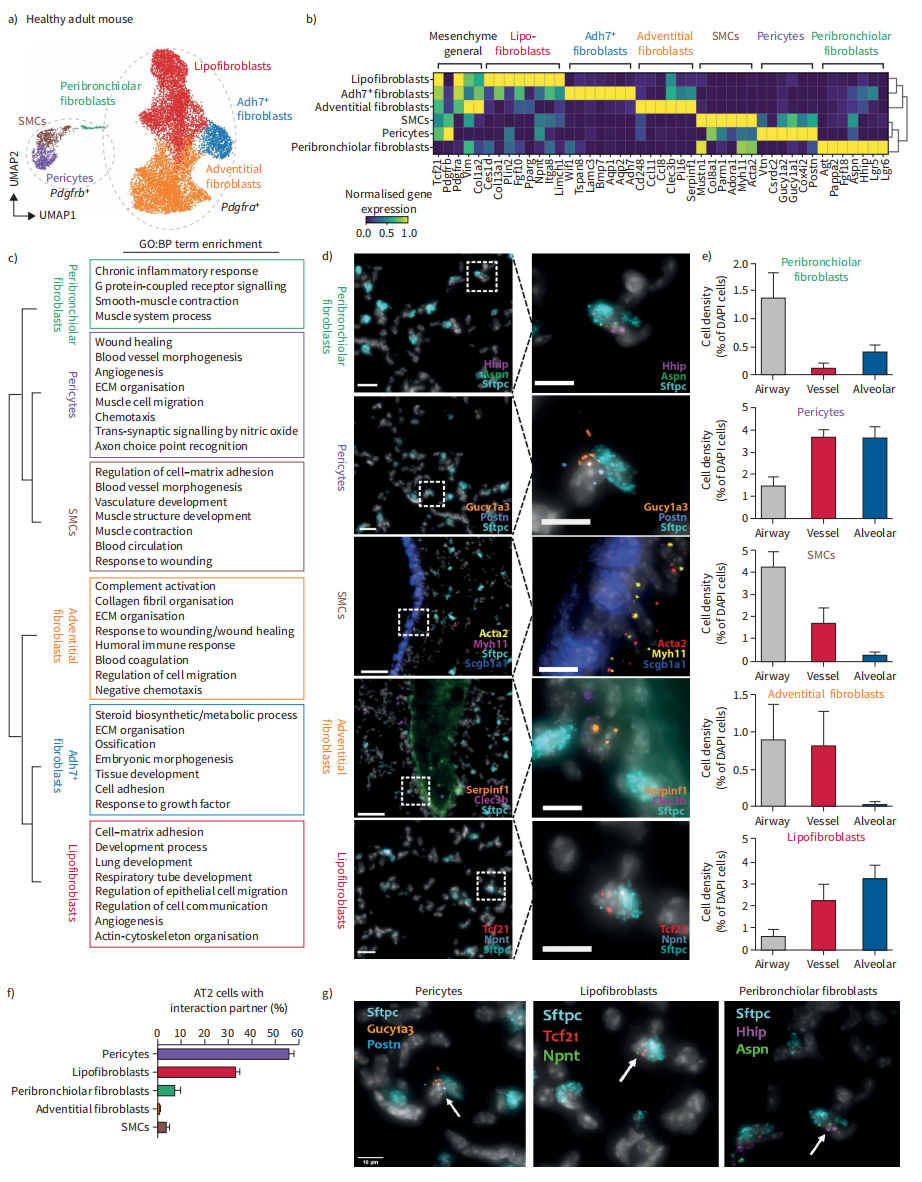
图 1
2. 以高表达strp1和Col28a1为特征的活化成纤维细胞状态
为了跟踪损伤和修复过程中成纤维细胞的命运,我们对博莱霉素诱导肺损伤后14天的Tcf21-CremR26R-tdTomato小鼠的细胞进行了分选,三个损伤诱导的细胞簇变得明显(图2A和B),它们是Tcf21谱系阳性和阴性细胞的混合物。我们鉴定了两种Cthrc1+/Acta2+肌成纤维细胞类型,其中一个亚簇显示Spp1表达增强(图2C和D)。一个簇共表达具有不同成纤维细胞标记的肌成纤维细胞基因,特别是来自脂肪成纤维细胞;将其命名为“过渡性成纤维细胞”(图2B-D),几个基因包括分泌卷曲相关蛋白1 (strp1),在这个假定的中间细胞群中表现出最高的表达(图2C和D)。组织蛋白质组学显示,博来霉素损伤后COL28A1和Sfrp1蛋白瞬间被诱导。Sfrp1和COL28A1共染色证实在ACTA2低或阴性的移行细胞中共表达(图2E),而CTHRC1+细胞表达更高水平的ACTA2(图2F)。
为了研究临床相关性,我们比较了博来霉素损伤后Col1a2+细胞与ILD患者Col1a2+细胞。Sfrp1特异于COL1A2+间充质细胞,在一些CLDN5+内皮细胞中表达较弱(图2G)。表达仅限于表皮成纤维细胞和疾病富集的“炎症”成纤维细胞亚群(图2G和H)。在所有三个研究队列中,疾病诱导成纤维细胞状态下Sfrp1的表达增加是一致的(图2I和J)。重要的是,在IPF组织中,更多的Sfrp1+成纤维细胞存在于轻度受影响(早期)区域,而终末期区域有更多的ACTA2+肌成纤维细胞定位于成纤维细胞灶(图2K-M)。这些数据表明,在人肺纤维形成中,成纤维细胞状态的轨迹与在博来霉素模型中看到的相似。
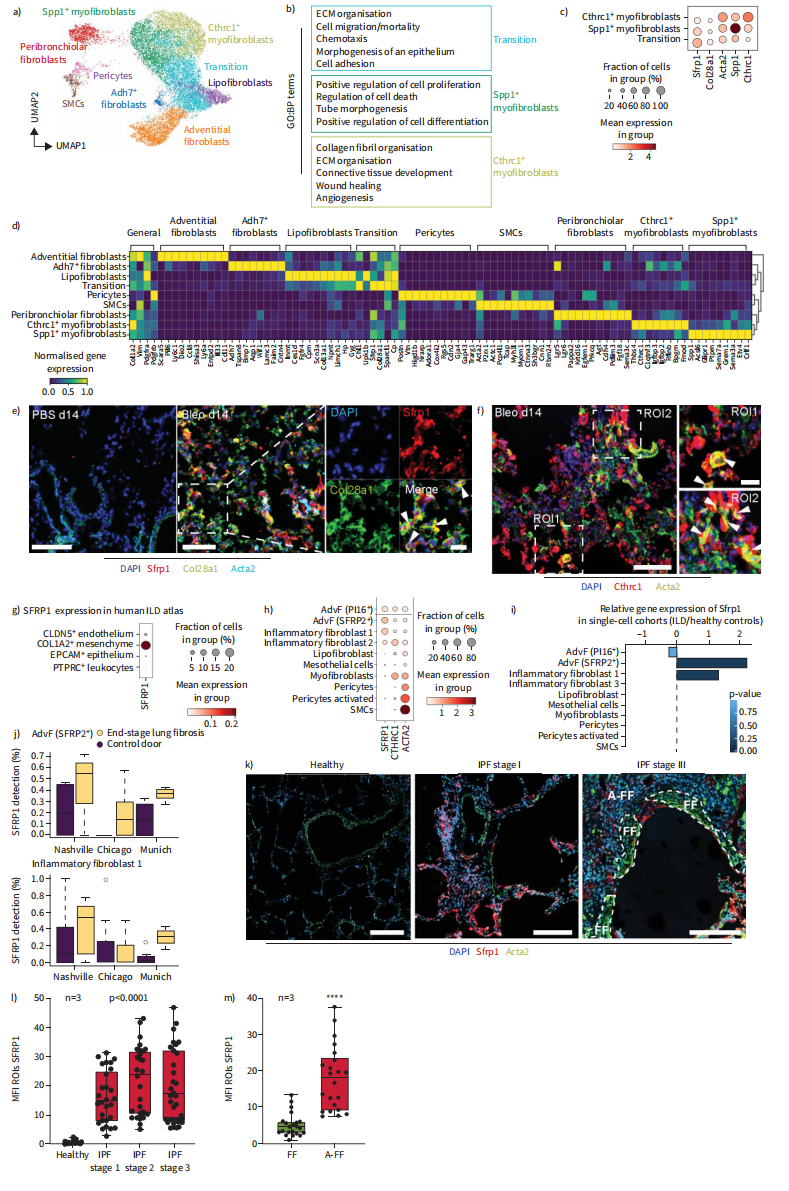
图 2
3. strp1+过渡性成纤维细胞先于Cthrc1+肌成纤维细胞出现
为了跟踪Col1a2+基质细胞在肺炎症再生期、纤维化期和消退期的转录动力学,我们收集了博来霉素损伤后18个时间点的Epcam−/Pecam1−/Lyve1−/CD45−基质细胞(图3A-C)。Col1a2+细胞(69185个细胞)的纵向scRNAseq数据集(图3B)具有三种不同的损伤诱导细胞状态,类似于Tcf21谱系追踪数据集(图3C)。Strp1+移行性成纤维细胞在第3天达到峰值,在第9天至第21天出现在Spp1+和Cthrc1+肌成纤维细胞之前(图3D)。使用免疫荧光(图3E-1)发现在健康的肺中除气道上皮管腔区存在非特异性信号外,Sfrp1、CTHRC1和SPP1大部分缺失(图3E)。COL28A1位于支气管血管口周围,而ACTA2主要在气道和血管附近的平滑肌细胞中观察到(图3E)。损伤后3天,气道、血管和肺泡周围出现了Sfrp1/COL28A1双阳性细胞,ACTA2在支气管血管平滑肌细胞中表达(图3F、G和J)。损伤后14天,在纤维化致密区,ACTA2-肌成纤维细胞和Sfrp1+ /COL28A1+细胞共存(图3H和I)。多重免疫荧光分析证实,第3天,Sfrp1+ /COL28A1+细胞增加。直到伤后第14天SPP1+和CTHRC1+肌成纤维细胞扩张(图3K),验证了我们在蛋白水平上的图3D的数据。
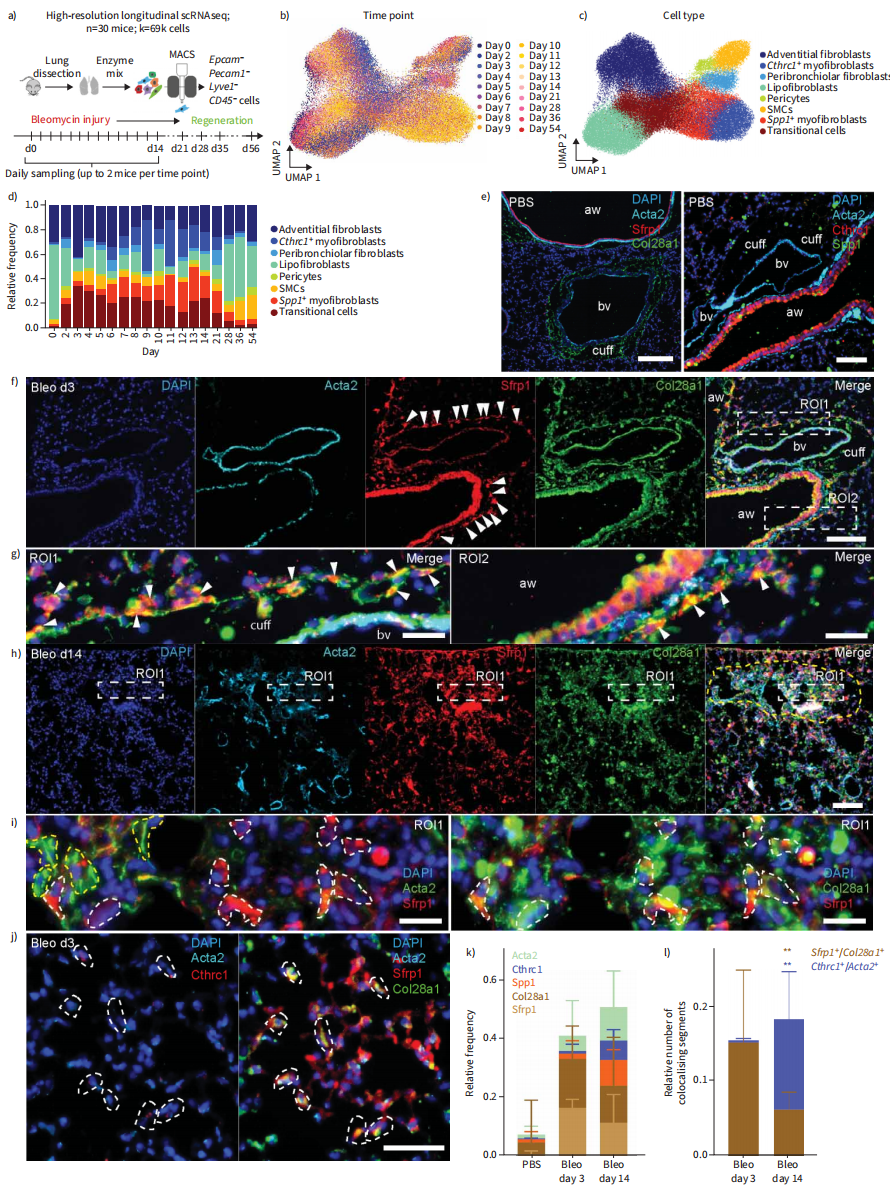
图 3
4. 多种间充质细胞类型向肌成纤维细胞身份的趋化
为了推断不同细胞类型和激活状态之间的谱系关系,我们使用了CellRank(图4)分析了三个阶段:“早期损伤”(图4A-C)、“纤维形成”(图4D-F)和“消退”(图4G-I)。CellRank热图展示了细胞命运的概率(图4A、D和G),而小提琴图则可视化了细胞之间的概率分布(图4B、E和H)。散点图中描绘了与不同命运轨迹相关的关键谱系驱动基因(图4C、F和I)。早期损伤期分析(2-5天)显示,外层成纤维细胞和脂肪成纤维细胞有很高的命运概率过渡到strp1 +状态(图4A、B)。只有少数Cthrc1+肌成纤维细胞(图4A和B)。迁移细胞的top驱动基因包括各种胶原、趋化因子,尤其是strp1,而肌成纤维细胞谱系显示的标记基因包括Tnc、Spp1和Thbs1(图4C)。在纤维形成阶段(第6天至第21天),CellRank预测了strp1 +细胞向肌成纤维细胞的转变(图4D、E)。肌成纤维细胞的顶级驱动基因代表了经典的肌成纤维细胞相关基因,包括Lgals1、Sparc和Spp1以及Cthrc1(图4F)。在分化阶段,分化概率表明Cthrc1+肌成纤维细胞向脂肪成纤维细胞、细支气管周围成纤维细胞和周细胞状态的逆转。这一预测与之前观察到的脂肪生成和肌生成成纤维细胞表型之间的双向转换有关。
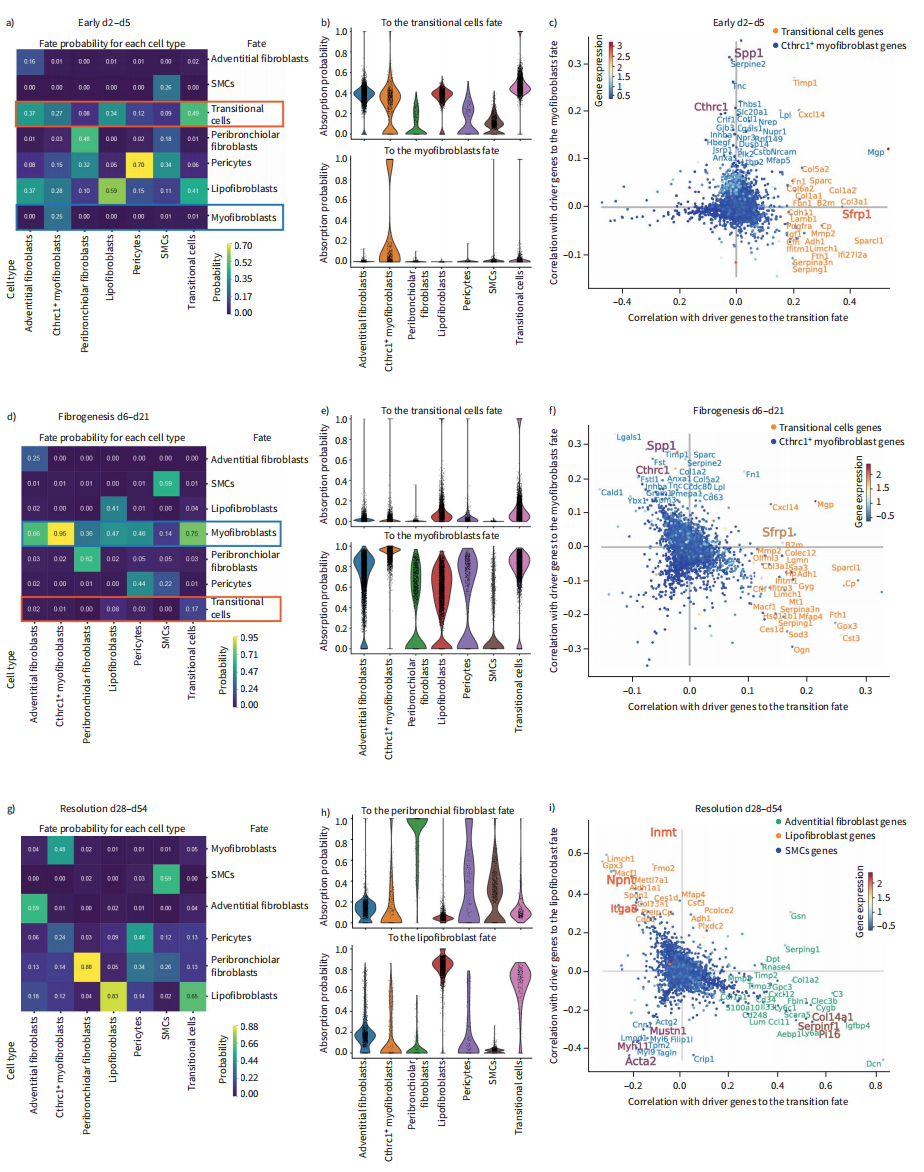
图 4
接下来,我们发现25种不同的胶原在损伤后或不同基质细胞之间具有动态表达模式(图5A)。此外,还鉴定出90个分泌的基质基因,它们在损伤时间过程中表达发生了显著变化(图5B)。所有细胞类型均表现出i型胶原(Col1a2)和肌成纤维细胞标志物ECM蛋白Sparc的短暂表达增加(图5C)。我们还观察到常见的早期成纤维细胞激活事件,如损伤后早期S100a6的上调(图5C)。细支气管周围成纤维细胞特别具有重要的分泌形态因子,如hip、Wif1、Fgf18和Wnt5a(图5D)。成纤维细胞衍生的Wnt信号,尤其是Wnt5a,在正常稳态下定义了一个特定的AT2细胞生态位,是人类远端气道中一个独特的间质生态位的一部分,由Lgr5+成纤维细胞分泌。除了损伤诱导的趋化因子如用于B细胞募集的Cxcl13,以及用于吸引T细胞、单核细胞和中性粒细胞的Cxcl12和Ccl8外,内皮成纤维细胞特异性地产生Wnt调节剂Strp4。有趣的是,趋化因子eotaxin (Ccl11)特异性标记了不受损伤影响的内皮成纤维细胞(图5E)。脂肪成纤维细胞特异性表达形态因子Wnt2和Bmp3,以及干细胞因子(SCF) (Kitl)(图5F)。在博莱霉素损伤的肺中,SCF-c-Kit通路被激活,通过向肺募集Kit+免疫细胞,具有潜在的促纤维化作用。
最后,我们的数据表明,损伤后早期,多种间充质细胞类型会聚为strp1+迁移细胞,最终产生Cthrc1+肌成纤维细胞,并有可能在消退期恢复为脂肪成纤维细胞、细支气管周围成纤维细胞和周细胞。
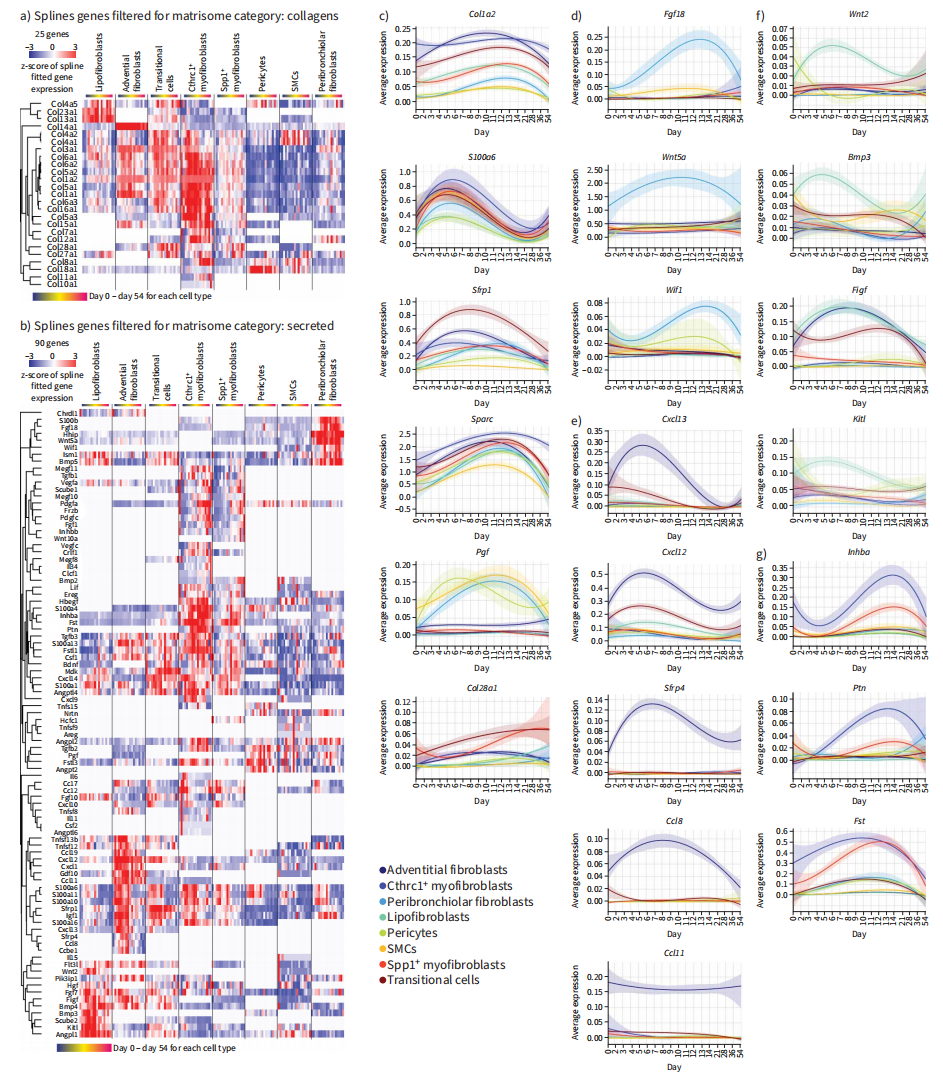
图 5
5. TGFβ介导strp1+过渡性成纤维细胞向肌成纤维细胞的分化
为了推断损伤后成纤维细胞状态转变的潜在调节因子,我们使用了NicheNet,它预测了最有可能诱导Sfrp1+迁移细胞和Cthrc1+肌成纤维细胞CellRank输出中顶层驱动基因表达的配体(图6A和B)。Sfrp1+迁移细胞上游的顶层配体是Notch配体Jag1,主要在分泌性气道上皮细胞中表达。肺泡上皮细胞和血管内皮细胞(图6A)也有较小程度的影响。与我们的发现一致,据报道,在博来霉素模型中,间充质细胞中Notch缺失会减少纤维化重构和肌成纤维细胞分化。值得注意的是,在Strp1+迁移细胞状态驱动基因的上游,顶级配体排除了TGFβ,而TGFβ是Cthrc1+肌成纤维细胞驱动基因的顶级配体。TGFβ1是顶配体,主要由髓系免疫细胞表达,TGFβ3由活化的AT2细胞和淋巴内皮细胞表达(图6B)。
在体外培养分离的原代小鼠和人肺成纤维细胞时,我们观察到标记基因的表达与体内的Strp1+过渡状态一致(图6C和D)。TGFβ1刺激后,SPP1和纤维化相关ECM标志物fn1上调,而Sfrp1下调(图6D)。我们使用定量PCR(图6E)、免疫荧光(图6F和G)和Western blot(图6I-K)在人和小鼠原代肺成纤维细胞中验证了这些观察结果。因此,我们验证了我们的计算预测,证明TGFβ1是原代成纤维细胞中控制Sfrp1和肌成纤维细胞标记物表达的主开关。
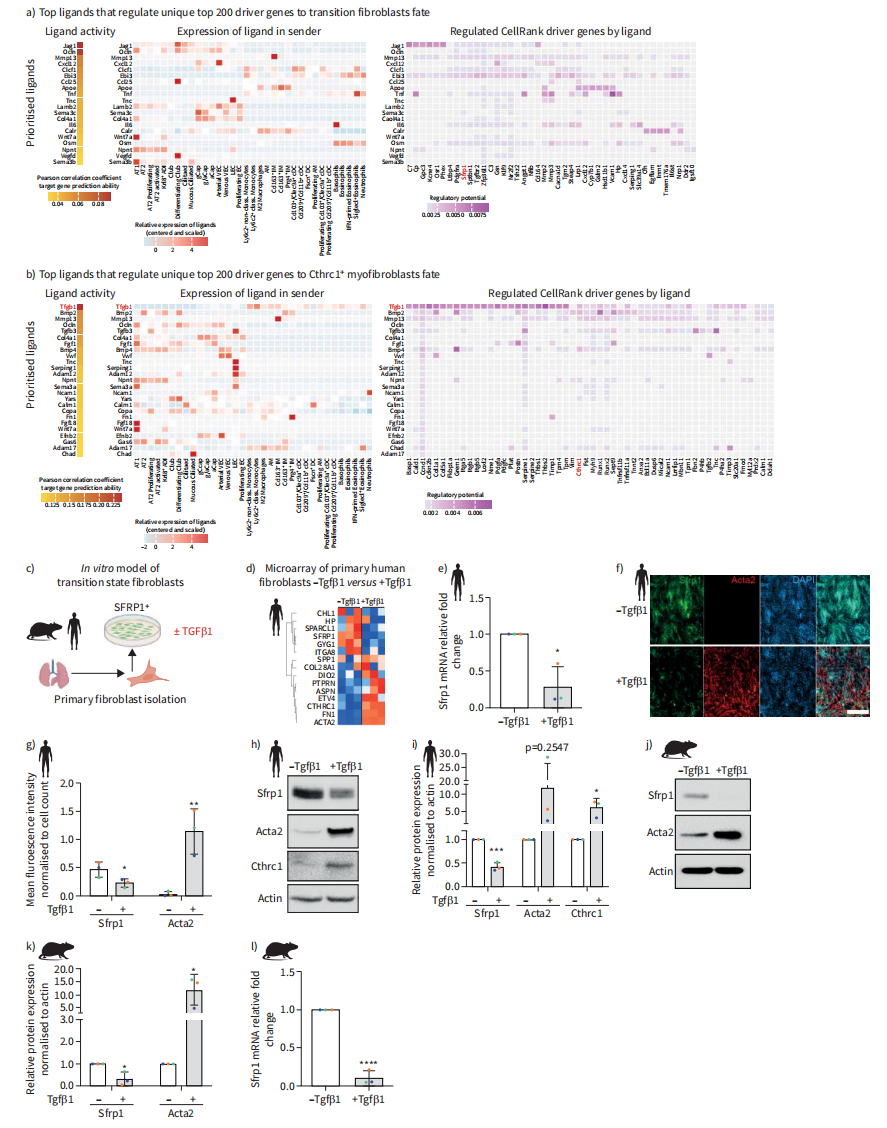
图 5
6. Sfrp1调节TGFβ1诱导的成纤维细胞侵袭和RHOA活性
分泌的Sfrp1是Wnt信号通路的抑制剂并调节肿瘤细胞侵袭。之前发现胶原侵入肺成纤维细胞的转录组特征,其特征是Strp1表达的显著降低。在纤维形成过程中,被激活的成纤维细胞被认为迁移到受损组织区域形成纤维化灶。博来霉素损伤后小鼠肺移植实验表明,与其他成纤维细胞状态相比,Cthrc1+肌成纤维细胞具有更强的迁移能力。为了检验Sfrp1在成纤维细胞侵袭中的作用,我们在来自四个供体的pHLFs中缺失了Sfrp1,并进行了胶原侵袭试验和转录组分析(图7A和B)。与对照组相比,Sfrp1缺失细胞的侵袭能力显著增强,与TGFβ1治疗相似(p<0.001)(图7C)。Sfrp1-siRNA和TGFβ1联合处理产生了逆转表型,阻止了TGFβ1诱导的侵袭。值得注意的是,在未处理的Sfrp1敲除细胞中,侵袭增加,而在TGFβ1刺激的细胞中,侵袭减少,通过重组Sfrp1至少部分恢复,表明Sfrp1依赖通路调节TGFβ1驱动的成纤维细胞表型(图7D)。对Sfrp1缺失成纤维细胞的大量转录组学分析表明,RHOA信号相关通路的下调可能是通过上调RhoGDI抑制信号来实现的(图7E)。
我们证实RHOA mRNA表达减少(图7F), RHOA- gtpase活性降低(图7G)。此外,Sfrp1敲低诱导细胞形态改变为细长细胞形状(图7H和图I)。为了测试RhoA抑制如何影响成纤维细胞侵袭,我们在Sfrp1缺失和对照细胞中使用RhoA抑制剂CT04,发现单独使用CT04显著增加细胞侵袭(图7J)。然而,我们确实发现CT04在Sfrp1缺乏的细胞中对细胞侵袭有一个小而显著的加性作用,这表明并非所有的Sfrp1对细胞侵袭的调节作用都严格依赖于RHOA途径(图7J)。综上所述,我们在pHLFs中的功能丧失实验揭示了Sfrp1通过调节RHOA途径部分调节TGFβ1诱导的成纤维细胞侵袭的功能。
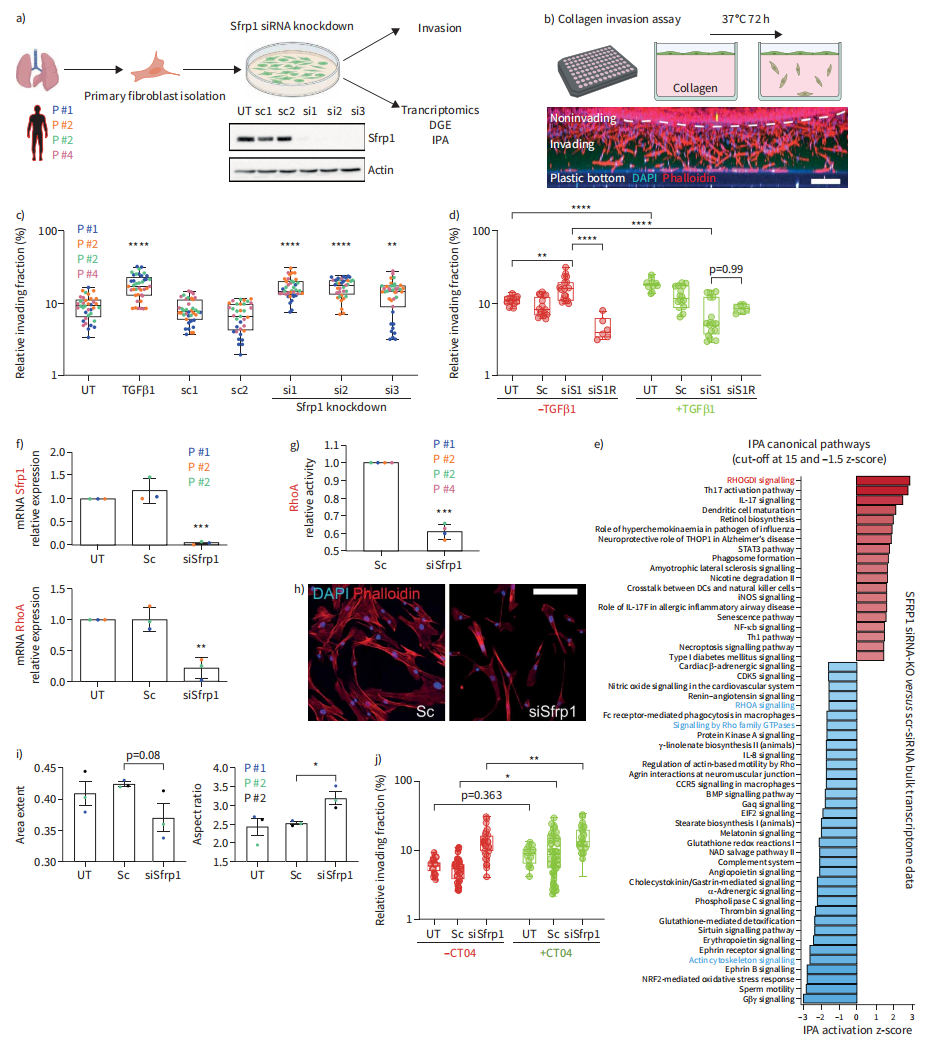
图 6
结论
成纤维细胞是组织平衡、免疫反应和伤口愈合的主导者。我们在细支气管周围的特定组织中描绘了成纤维细胞谱系的损伤诱导激活状态。纵向单细胞和谱系追踪实验揭示了一种新的迁移细胞状态和高度细胞类型和谱系特异性的旁分泌信号,介导了肺再生的特殊功能。我们的分析进一步表明,在肺纤维化的肌成纤维细胞转化过程中,Sfrp1是TGFβ1诱导的成纤维细胞侵袭的关键调节剂(图8)。目前的IPF/ILD发病模式涉及与特定遗传因素相关的异常和持续修复。博来霉素小鼠模型可能更准确地概括了IPF/ILD发病的早期阶段,并在疾病进展的后期阶段失去相关性。事实上,我们发现在博来霉素损伤后的早期阶段和IPF外植体中轻度受影响区域的Sfrp1+迁移性成纤维细胞有有趣的相似性。这表明,在反映ILD/IPF早期阶段的博来霉素小鼠模型中,成纤维细胞激活状态具有高度的临床相关性。
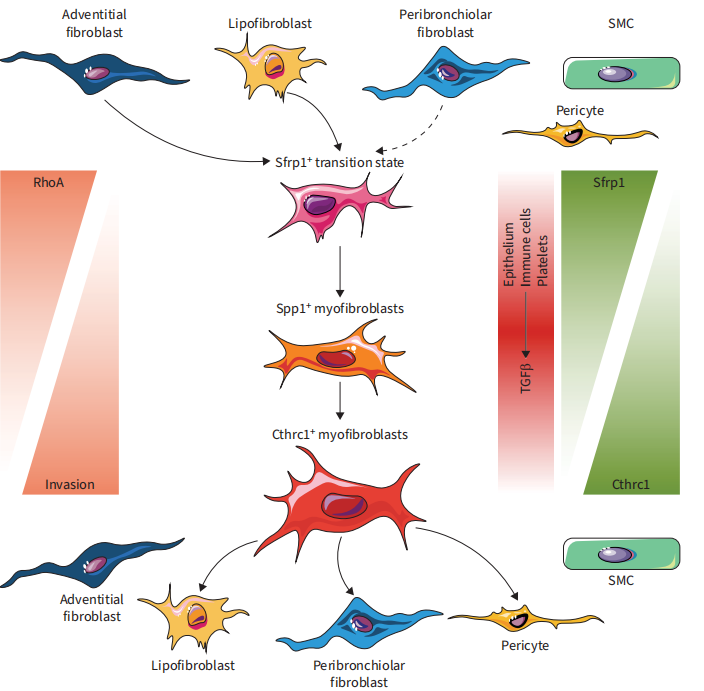
图 7
我们在Tcf21-Cre报告小鼠的肺上使用单细胞转录组学来解决脂肪成纤维细胞的谱系轨迹。然而,局限性在于除了hip+细支气管周围成纤维细胞外,所有其他间充质细胞类型也由于低水平的Tcf21表达而被标记为谱系。先前的研究证实,成纤维细胞侵袭有助于肺纤维化的进展和严重程度。我们在这里发现,损伤激活的成纤维细胞的早期Strp1+过渡状态是非侵入性的,这表明损伤激活的成纤维细胞具有局部小众功能,如通过外表皮成纤维细胞募集免疫细胞,或通过脂肪成纤维细胞、周细胞和hip+成纤维细胞激活上皮干细胞。我们的细胞侵袭数据表明,在pHLFs中,Sfrp1的可用性决定了TGFβ1是否诱导前侵袭或抗侵袭行为。在IPF等病理中,肌成纤维细胞侵入并将自身组织成致密的聚集体,称为成纤维细胞灶,这一过程也在博来霉素模型中得到了概括。因此,本研究中发现的机制对IPF开辟了新的治疗干预途径,对应限制或逆转成纤维细胞灶的形成具有直接意义。
参考文献:
Mayr CH, Sengupta A, Asgharpour S, Ansari M, Pestoni JC, Ogar P, Angelidis I, Liontos A, Rodriguez-Castillo JA, Lang NJ, Strunz M, Porras-Gonzalez D, Gerckens M, De Sadeleer LJ, Oehrle B, Viteri-Alvarez V, Fernandez IE, Tallquist M, Irmler M, Beckers J, Eickelberg O, Stoleriu GM, Behr J, Kneidinger N, Wuyts WA, Wasnick RM, Yildirim AÖ, Ahlbrecht K, Morty RE, Samakovlis C, Theis FJ, Burgstaller G, Schiller HB. Sfrp1 inhibits lung fibroblast invasion during transition to injury-induced myofibroblasts. Eur Respir J. 2024 Feb 8;63(2):2301326. doi: 10.1183/13993003.01326-2023. PMID: 38212077; PMCID: PMC10850614.
