KDM5C主要通过促进铁死亡来抑制致瘤性
PPP在抗ROS活性和肿瘤侵袭上具有重大意义,其中间产物NADPH是铁死亡的指标。为了明确KDM5C在ROS抗性和铁死亡中的潜在作用,作者通过ROS诱导处理来比较各种ccRCC细胞系ROS抗性。与其他ccRCC细胞系相比,RCC4表现出相对较高的ROS抗性(图6 A)。在用TBHP处理后,与RCC4-H514A细胞相比,RCC4-KDM5C有更多的细胞死亡(图6 B)。同时,在TBHP诱导下,KDM5C导致ROS水平显着增加(图6 C)。此外,KDM5C显著增强了Erastin介导的细胞死亡(图6 B),这可以被Ferr-1或DFO有效逆转,但不能被Z-VAD或Nec-1s逆转。因此,与RCC4-H514A细胞相比,RCC4-KDM5C细胞中Erastin诱导的脂质过氧化增加更明显(图6 D)。
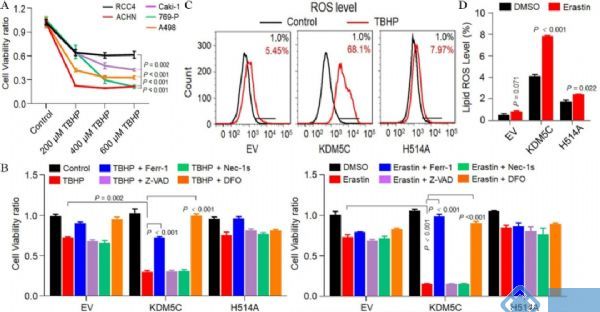
图6. KDM5C主要通过抑制铁死亡来抑制致瘤性
KDM5C敲除赋予癌细胞对ROS和铁死亡的抵抗力
敲除KDM5C后,与几种ccRCC细胞系对TBHP和Erastin的抵抗力显著增强(图7 A、B)。值得注意的是,在糖原磷酸化酶抑制剂(GPI)会抑制其抗性(图7 C),这表明KDM5C蛋白介导的糖原重编程的缺失对于抗ROS和铁死亡是必不可少的。
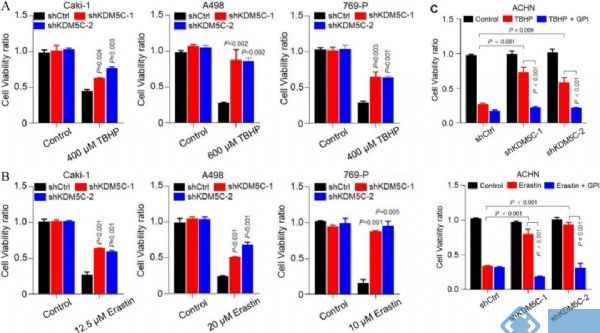
图7. KDM5C的缺失使老化的肾细胞和ccRCC细胞对铁死亡具有抗性
癌症相关的KDM5C突变在抑制糖原积累和促进铁死亡方面存在缺陷
测序鉴定到大部分突变在JmjN和JmjC结构域中富集(图8 A),为了评估这些癌症相关的KDM5C突变对糖原积累和铁死亡的影响,选择了几个JmjN和JmjC结构域相关的错义突变,并构建了稳定表达突变蛋白的相应RCC4细胞系(图8 A)。有趣的是,所有这些突变体都表现得像H514A,不能有效地降低糖原和G6P水平(图8 B),并且它们都没有使细胞对铁死亡或ROS诱导剂敏感(图8 C)。
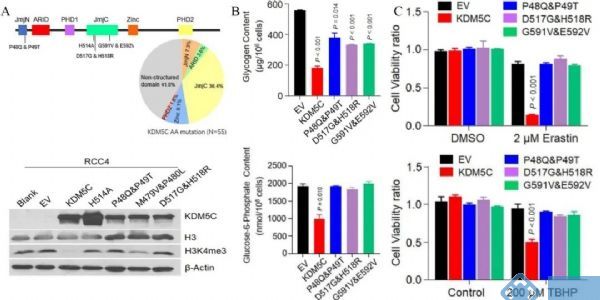
图8. 临床相关的KDM5C突变体未能降低糖原水平并抑制铁死亡
基于前面的结果,作者提出了ccRCC中失活KDM5C突变的模型。如图9所示,雌性KDM5C有两个活性等位基因;因此,在单个基因改变后,雌性不会完全丧失基因。相比之下,在男性中,一个肾细胞突变使KDM5C基因的唯一等位基因失活,从而可能通过增加糖原生成/糖原分解和抑制铁死亡来促进肿瘤发生。因此,男性更容易患ccRCC。
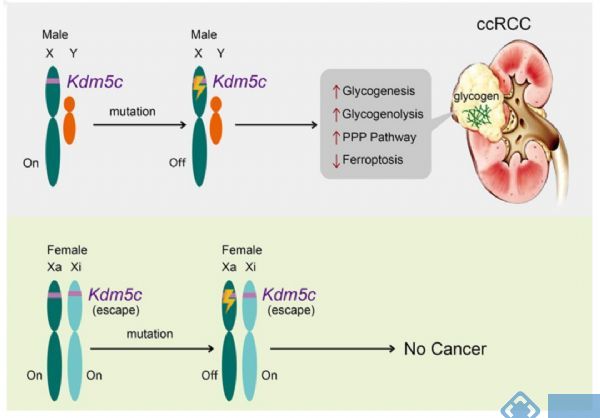
图9. 失活KDM5C突变和ccRCC发病模型
结 论
,
发表期刊:Theranostics
发表时间:2021.08.04
影响因子:11.556
合作客户:武汉大学
百趣提供的服务:PPP、EMP靶标代谢流
研究背景
此外,ccRCC患者存活率较低可能与磷酸戊糖途径(PPP)的上调有关,因此糖原代谢可以作为治疗靶点,但是,ccRCC中糖原累积和相关致癌功能的遗传因素尚不完全清楚。
本文利用全外显子组与RNA测序评估KDM5C在ccRCC中的功能,结合靶标代谢流研究KDM5C如何影响细胞内代谢通量。同时还对小鼠进行KDM5C基因敲除收集更多的体内证据,揭示了组蛋白修饰基因失活突变重编程糖原代谢的机制,并有助于解决人类癌症中男性占主导地位的长期难题。
研究内容
具有最高糖原水平的 ccRCC 细胞系存在着 KDM5C 基因移码突变
对ccRCC 6个细胞系进行高碘酸-希夫 (PAS) 染色和糖原定量测定发现,相比于其他同样缺乏 VHL基因的癌细胞系,RCC4表现出最高的糖原水平(图1 A、B)。此外,外显子测序结果表明RCC4细胞中KDM5C和VHL出现移码和错义突变,WB结果发现RCC4细胞中不存在KDM5C和VHL蛋白(图1 C、D),由此表明癌细胞中的高糖原水平可能与KDM5C突变有关。
为了验证KDM5C的恢复是否会降低RCC4细胞中的糖原水平,构建了野生型KDM5C或其酶失活突变体H514A的RCC4细胞系,PAS染色结果和糖原定量测定结果表明KDM5C能有效降低糖原水平(图1 E、F),KDM5C突变促进ccRCC中糖原的形成。
鉴于KDM5C是X失活逃逸基因,作者分析不同性别的患者的情况,发现在ccRCC中频繁突变的基因中,KDM5C突变表现出最高的男女比例(图1 G),KDM5C蛋白水平在ccRCC患者中下降,同时糖原显著增加(图1 H),这就解释了为什么ccRCC患者大部分为男性。
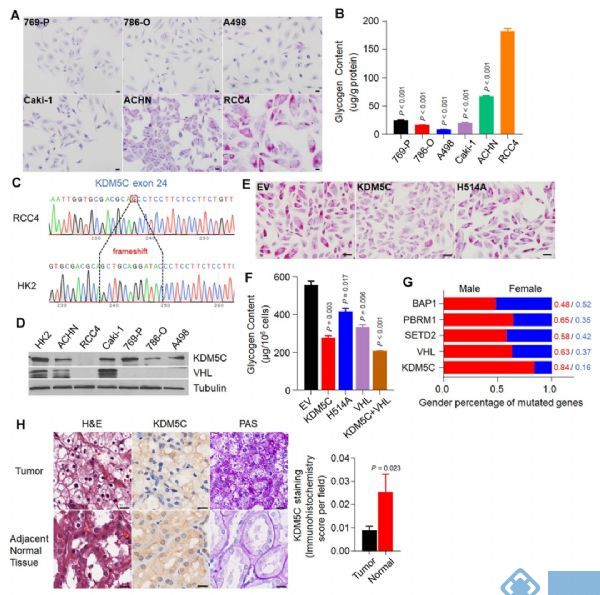
图1. X失活逃逸基因KDM5C在糖原水平最高的ccRCC细胞系中具有移码突变
KDM5C缺失引起ccRCC特异性代谢表型
为了证实KDM5C缺失导致ccRCC发生和糖原积累,作者进行KDM5C敲除实验。在对照组中,雌性肾脏中的KDM5C蛋白水平高于雄性(图2 A)。相比于对照组,在50%的KDM5C敲除小鼠中观察到肾囊肿(图2 B),其管腔的上皮细胞显示出强Ki67染色(图2 C),KDM5C敲除小鼠的肾小管表现出细胞质糖原累积升高(图2 D), 表明KDM5C缺失可能引发ccRCC特异性代谢表型并促进肿瘤形成。另外,KDM5C敲除稳定细胞系的PAS染色和糖原定量结果均表明KDM5C耗尽后糖原水平增加(图2 E-H)。
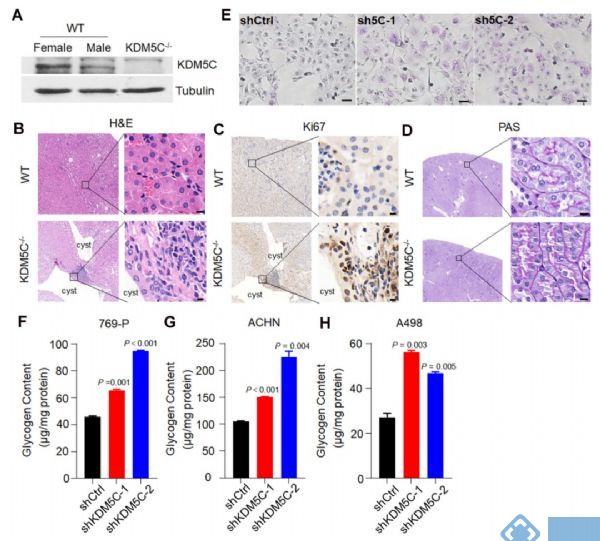
图2. KDM5C敲除引发ccRCC特异性代谢表型
上海阿趣生物科技有限公司 商家主页
地 址: 嘉定区新培路51号焦点梦想园5层
联系人: 高小姐
电 话: 400-664-9912
传 真:
Email:marketing@biotree.cn
