
期刊:Cell Metabolism
影响因子:29
伯豪生物产品服务:伯优®组织样本悬液制备试剂盒、单细胞转录组测序服务
研究背景
在不利环境条件下,胚胎发育可能会可逆地停止,这一过程被称为滞育。最近有研究表明,肿瘤细胞可以降低药物的毒性,通过类滞育的现象,降低肿瘤细胞的凋亡死亡率。另有报告称,当结直肠癌(CRC)细胞受到细胞毒性药物治疗时,它们会进入一种类滞育的状态。而这些类滞育的癌细胞(DLCC)与没有基因突变的癌干细胞不同,化疗期间复发性肿瘤的克隆复杂性不会消失。然而,关于癌细胞向类滞育状态(缓慢增殖和对化疗耐药)转变的分子机制以及建立这些细胞的生物标志物谱尚需进一步的研究。
研究目的
为了探究DLCCs的基因特征,研究鉴定了各种滞育相关条件(包括营养剥夺和化疗)之间共同变化的基因,并将它们与真正的胚胎滞育基因相结合。这种方法表明,在滞育转换过程中,结构维持染色体4(SMC4)的下调是一个常见事件。之前的一项肿瘤学研究表明SMC4的下调在基因组不稳定性中起作用,表明其下调是CRC进展的驱动因素。因此,本文使用CRC作为模型系统,旨在揭示SMC4下调在滞育转换中的功能意义。
研究结果
1. SMC4被鉴定为CRC中类滞育状态的负调节因子
目前已发表的滞育的研究中,鉴定出的相关基因数量相对较多,无法进行经验分析,因此本研究假设进一步细化滞育特征有助于鉴定导致癌细胞切换到滞育类状态的关键基因。由于血清和葡萄糖剥夺是诱导胚胎干细胞滞育的一种方法,研究者调查了HCT116人CRC细胞在去除血清和葡萄糖后引起的转录组变化。此外,鉴于滞育是一种保守过程的概念,研究者还整合了小鼠滞育胚胎的分析。
通过对个别数据集与由Rehman等定义的110个“胚胎滞育下调”特征集进行基因集合富集分析(GSEA),结果显示HCT116和小鼠胚胎数据集均显著富集,并且该特征基于的DTP数据集也显著富集。这表明这三个数据集中共同变化的基因可能代表了滞育的关键介质。
在此基础上,研究者对这三个数据集中差异基因的交集进行分析。通过系列实验,发现SMC4的下调是所有实验系统中唯一一致的变化。因此,该研究的后续的研究工作重点放在了探讨SMC4在癌症休眠中的作用。
之后,研究者在HCT116细胞中沉默了SMC4,并评估转录组的变化。经GSEA分析显示,SMC4敲低显着富集了胚胎停滞下调基因的变化。

此外,沉默SMC4显著抑制了HCT116细胞在2D和3D培养中的增殖。
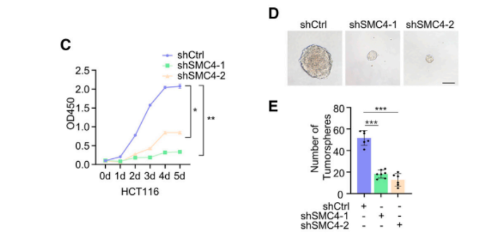
同时,研究者在患者和实验性结肠肿瘤组织中观察到增殖标记物Ki67和SMC4的染色之间的定量测量和空间分布的存在相关性。
使用HCT116细胞的实验发现,使用短发夹RNA(shRNA)沉默SMC4导致伊立替康的IC50值显着增加,而重新表达SMC4可逆转细胞对化疗药物的不敏感。

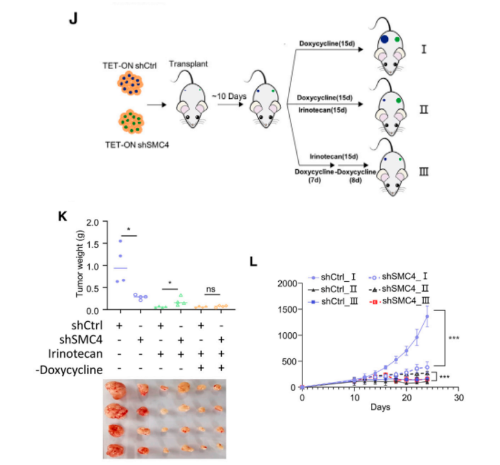
然后,使用HCT116衍生的小鼠异种移植物进行了在体研究。然而,考虑到在SMC4沉默后观察到的对细胞生长的抑制作用,我们采用了强力霉素诱导的TET-On系统,该系统可以在肿瘤形成后进行敲除。实验结果发现,肿瘤形成后10天开始进行SMC4敲低会抑制肿瘤的生长。然而,结合伊立替康治疗,SMC4基因敲除的肿瘤生长速度明显快于对照组肿瘤,表明SMC4基因敲除的肿瘤对化疗失去了敏感性。重要的是,去除SMC4基因敲除肿瘤中的强力霉素后,它们对伊立替康的敏感性得以恢复,这表明与SMC4缺失相关的生长抑制效应是可逆的。
2. DLCCs中糖酵解和乳酸的增加促进了其对化疗的不敏感性
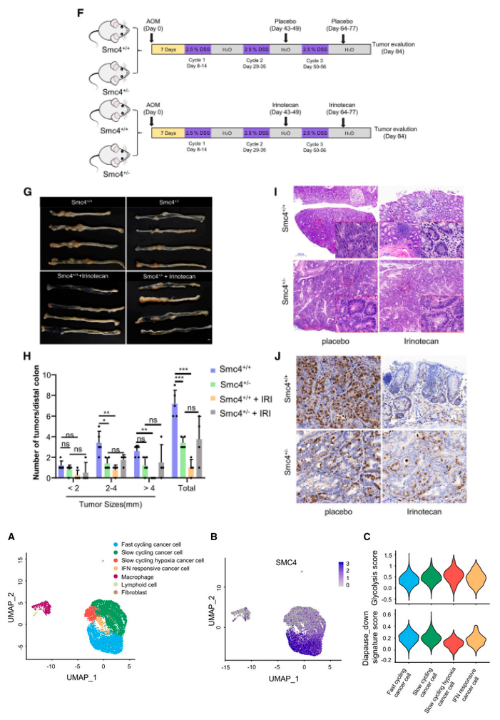
为了探索滞育样细胞是否在体内发生,研究者对MC38肿瘤进行了单细胞RNA测序(scRNA-seq)。该测序分析中包含9618个转录组,对应于4种主要细胞类型,即癌症细胞、淋巴细胞、成纤维细胞和巨噬细胞。SMC4主要在快速循环的癌症细胞中表达,说明其与增殖相关。与其他慢循环细胞相比,对反应缺氧环境的慢循环肿瘤细胞显示出最低的SMC4表达。从测序结果中还发现,该细胞群体具有最高的糖酵解评分和最低的胚胎滞育下降特征评分,这表明低SMC4表达的DLCCs的的糖酵解反应显著增强。
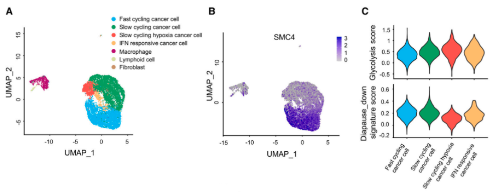
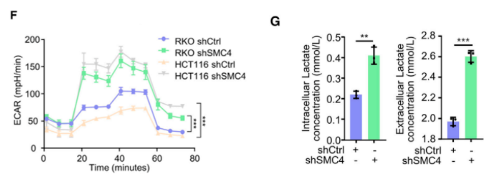
另外,研究发现标志性的糖酵解途径在SMC4沉默的HCT116细胞的GSEA分析中显著富集。此外,针对所有主要糖酵解酶的蛋白质印迹结果显示,SMC4沉默与己糖激酶2(HK2)、磷酸果糖激酶、肝脏(PFKL)和醛缩酶C(ALDOC)的表达增加以及PGAM1的降低有关,而与其他糖酵解酶类没有显著变化。为了进一步验证这些变化足以改变糖酵解通量,研究通过Seahorse XF测量了细胞外酸化率(ECAR)作为衡量糖酵解通量的标准。结果发现,HCT116和RKO结肠癌癌症细胞中SMC4的敲低与糖酵解测量的增强有关。与这些发现一致,SMC4沉默后,葡萄糖利用率以及细胞外和细胞外乳酸水平增加。乳酸是葡萄糖厌氧分解的产物,也有文献指出了其在增强癌症细胞对化疗的不敏感性中的作用。为了验证SMC4敲低诱导的滞育样细胞的药物不敏感性是否与乳酸产生有关,用糖酵解抑制剂2-脱氧葡萄糖(2-DG)或乳酸脱氢酶(LDH)抑制剂草酸钠,处理HCT116细胞,以阻断细胞乳酸产生。结果发现,草酸盐处理降低了对照组和SMC4沉默细胞对伊立替康敏感性的差异,而2-DG完全消除了这种差异。
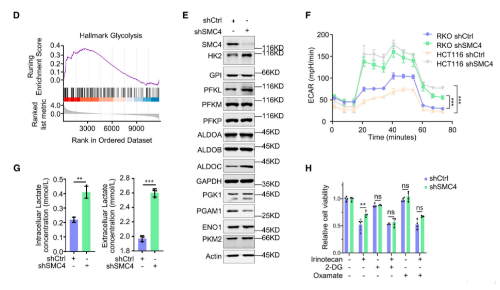
因为化学敏感性的变化在体内环境中最为相关,所以该研究使用异种移植物模型来验证这些发现。与对照组相比,SMC4沉默的肿瘤的生长潜力降低,但对伊立替康的不敏感性明显增加。此外,尽管单独用2-DG治疗不会影响对照或SMC4沉默的肿瘤的生长,但用2-DG和伊立替康联合治疗可以逆转SMC4沉默的肿瘤表现出的药物不敏感性。相反,在伊立替康治疗后,SMC4沉默的肿瘤显示出更高的增殖率,但与2-DG联合治疗抵消了这一优势。从这些实验结果可知,糖酵解的变化和乳酸的增加对SMC4沉默的滞育样表型具有重要的功能性影响,因此后续的实验进一步探究了乳酸在其中的作用。
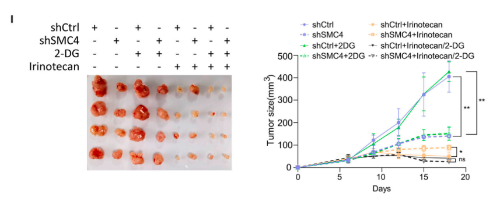
3. 组蛋白乳酸化促进DLCC中ABC转运蛋白的增加
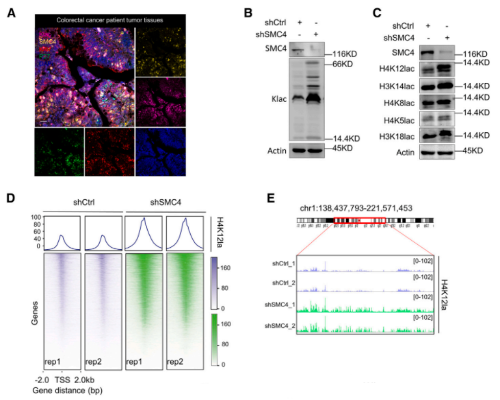
目前有关乳酸盐的研究,已经发现其作为组蛋白中赖氨酸残基乳酸化的前体的重要意义。由于SMC4沉默细胞对化疗的不敏感性依赖于乳酸盐,因此,改研究尝试评估这种表型是否由组蛋白乳酸化的变化引起。首先,研究确认了CRC组织中存在具有高糖酵解、低增殖特征的细胞,其中糖酵解水平是由乳基化赖氨酸残基的泛特异性抗体(Klac)来衡量的。同时,使用Klac的初步分析显示,在SMC4沉默后,细胞裂解物中的乳酸化水平大量增加。靶向组蛋白H3或H4的位点特异性抗体证实了这些变化,观察到其对H4K8la、H4k12la和H3K14la的反应活性增加,其中H4k12a的后一种变化最为显著。根据这一发现,研究采用CUT&Tag技术来分析H4k12la修饰的全基因组变化。结果发现,检测到的峰值分布的显著变化与SMC4沉默有关,整个基因组的信号显著增加,并且集中在转录起始位点(TSS)附近。
此外,GSEA分析显示,SMC4沉默显著富集了KEGG“BC转运蛋白途径”中的基因变化,相关的ATP驱动的泵蛋白在调节肿瘤药物流出和治疗耐药性中中起到重要作用。而为了确认H4K12la的变化是否是增强特定ABC转运蛋白转录的原因,研究者考虑了ABC转运蛋白基因的亚群,这些基因在SMC4沉默后表现出不同的H4K12a启动子峰以及表达水平的改变。在已鉴定的候选基因中,qPCR分析证实了三个候选基因ABCC2、ABCC3和ABCC10,在SMC4缺失后均显著增加。同时,使用免疫沉淀(ChIP)法对ABCC2、ABCC3和ABCC10中H4K12la修饰水平的分析同样证实了,在SMC4沉默后,所有基因启动子都表现出H4K12a信号的显著增加。因此,ABCC2、ABCC3和ABCC10中H4k12la修饰的增加与其表达的增加有关。而为了证实乳酸和ABC基因调控之间的因果关系,后续的研究对乳酸水平进行了人为的增加或降低。实验表明,用外源性乳酸盐或丙二醇酮处理细胞提高了乳酸盐水平,会显著增加了ABCC2、ABCC3和ABCC10的表达,而使用2-DG或草酸钠抑制细胞内乳酸盐的产生则会降低了它们的表达。综上所述,高乳酸水平有助于驱动ABC基因表达。最后,鉴于ABC转运蛋白与癌症细胞对化疗的敏感性之间存在密切关系,该研究又通过,加入ABCC2抑制剂丙酸,成功逆转了SMC4沉默细胞对伊立替康的不敏感性,证实了药物流出有助于类滞育CRC细胞的耐药性。

4.DLCCs中的细胞分裂失败和多倍体是通过减少F-肌动蛋白组装引起的
在SMC4敲低诱导的DLCCs中,随着细胞大小和多倍体细胞存在的增加,也会产生表型上变化。这些变化在HCT116细胞的图像中不太明显,但在RKO和MC38细胞中很明显。与没有多倍体的区域相比,CRC组织中的多倍体细胞群体似乎也表现出较低的SMC4表达水平。由于多倍体通常是由胞质分裂失败引起的,研究又对SMC4沉默是如何影响这一过程的进行了探索。为了确认SMC4是否影响收缩环的形成,研究者对分裂细胞中F-肌动蛋白和肌球蛋白II分布进行了观测,发现SMC4沉默的细胞,收缩环形成失败,染色区域集中在分裂细胞核附近,但不在分裂细胞核之间聚集。使用检测活细胞中F-肌动蛋白的lifeact探针进行的替代分析表明,SMC4沉默的细胞未能进行胞质分裂,这与F-肌动蛋白的异常分布有关。
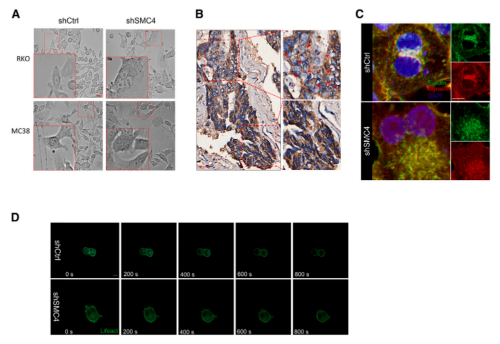
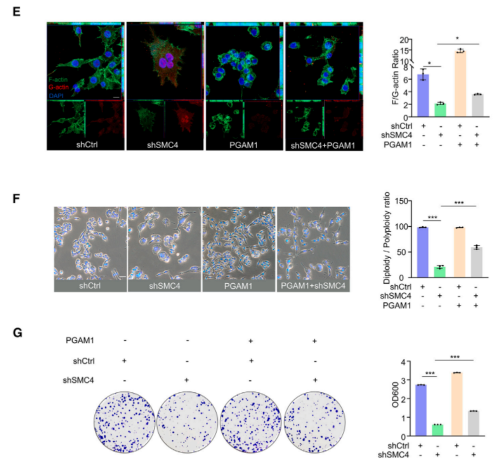
已有研究指出,PGAM1通过与α-肌动蛋白2(ACTA2)结合以增加F/G-肌动蛋白比率,在促进F-肌动蛋白组装中发挥非酶促作用。而该研究发现,PGAM1的过表达可以促进对照细胞中F/G-肌动蛋白比率的显著增加,并且与SMC4沉默相结合,可以在很大程度上逆转F/G-肌动蛋白比例的降低以及多倍体的增加。同时,该研究也证实了异位表达的PGAM1可以部分补偿SMC4沉默引起的细胞增殖能力下降。这些结果表明,伴随SMC4敲低而来的PGAM1表达降低,通过其对胞质分裂的非酶作用,有助于产生类滞育表型。
5. 抑制SMC4会增强原位小鼠模型对化疗的不敏感性
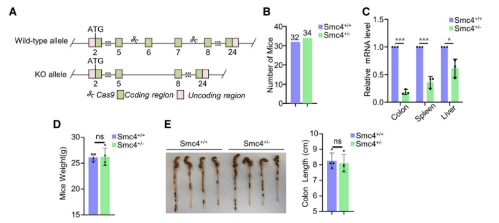
接着,本研究又从胚胎发生和肿瘤发生的双重角度来探究SMC4在体内的意义及其与细胞滞育的关系。首先,研究者利用CRISPR-Cas9技术破坏了小鼠中的SMC4转录本,并猜想SMC4的大规模缺失可能导致胚胎死亡。而后续结果验证了此猜想,Smc4+/-杂合小鼠之间的交配未能产生Smc4-/-纯合小鼠,而且杂合小鼠的产生频率也低于预期的Men-delian频率。这表明SMC4缺失存在一定程度的单倍充足性,但确切原因尚不清楚。然后,本研究还测试了SMC4在主要器官中的表达水平,包括结肠、脾脏和肝脏。实验发现,SMC4在SMC4+/-小鼠的器官中的表达较低。然而,对有活力的Smc4+/-小鼠的体重跟踪显示,与野生型同窝出生的对照组相比,没有差异。此外,杂合小鼠没有表现出明显的异常,例如,Smc4+/-小鼠和野生型同窝小鼠的结肠长度没有显著变化。
然后,研究者将这些小鼠与偶氮乙烷(AOM)/右旋糖酐硫酸钠(DSS)诱导的CRC模型相结合,试图发掘SMC4表达对肿瘤发生和化疗反应的影响。结果在肿瘤发生中观察到了显著的变化,其中Smc4+/-小鼠的远端结肠肿瘤的数量和大小显著少于野生型同窝出生的小鼠,并且Smc4+/-肿瘤组织含有明显较少比例的有丝分裂癌症细胞。然后,该研究又进一步揭露了SMC4的减少是如何影响伊立替康作用的。研究发现,伊立替康的治疗显著抑制了肿瘤的发生,但Smc4+/-肿瘤组织的生长速度明显快于野生型同窝出生的肿瘤,这表明Smc4+/-肿瘤对化疗的敏感性降低。Smc4+/-和Smc4+/+肿瘤中糖酵解酶表达的比较显示,与细胞系实验中观察到的变化一致,肿瘤组织中的HK2和PFKL增加,PGAM1水平降低。
研究总结
本文揭示了SMC4在结直肠癌细胞向类滞育状态切换过程中的多种作用。SMC4减弱可促进糖酵解酶的表达,增加乳酸的产生,同时抑制PGAM1。由此产生的高乳酸水平通过组蛋白乳糖基化增加ABC转运体的表达,导致肿瘤细胞对化疗不敏感。SMC4是PGAM1转录的协同激活剂,而SMC4和PGAM1的协同缺失会影响F-actin组装,导致有丝分裂失败和多倍体形成,从而抑制细胞增殖。这些对非遗传化疗耐药机制的洞察可能对该领域具有重要意义,增进我们对肿瘤中需氧糖酵解功能的理解,并可能为未来的治疗策略提供参考。
原文链接
https://linkinghub.elsevier.com/retrieve/pii/S1550-4131(23)00264-4
