论文题目:m6A modulates neuronal functions and sex determination in Drosophila
发表时间:2016年12月
发表期刊:Nature
影响因子:40.1
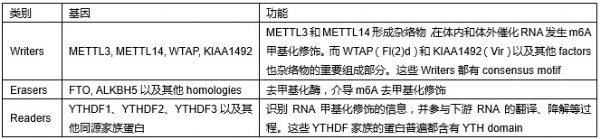
RNA修饰在表观转录调控中十分重要,其中m6A修饰在许多哺乳动物中广泛存在。许多真核生物中都存在m6A修饰,包括人、小鼠、斑马鱼甚至酵母。许多研究表明大量的m6A修饰落在了RRACH motif(R, purine; H, non-guanine base)内,另外终止密码子和3’UTR区域也有大量的m6A修饰。RNA甲基化修饰参与许多转录后调控,包括mRNA前体剪切,mRNA降解和翻译,其中的“reader”酶YTH家族起到十分重要的作用。RNA甲基化转移酶(methyltransferase)能够催化腺苷酸N6位发生甲基化,包括METTL3、METTL14、WTAP、Vir等,而去甲基化酶包括FTO和ALKBH5。
已知在小鼠胚胎干细胞中将METTL3敲除(knockout)后能够阻止其发生分化,MELLT3基因功能缺失对小鼠胚胎干细胞的发育具有致死作用。同样在果蝇中,METTL3的同源蛋白Ime4被敲除后也具有亚致死作用,由于NOTCH信号通路受损从而影响果蝇的生育能力。在模式植物拟南芥中,METTL3同源蛋白Ath-MTA被敲除后,其发育也会受到很大影响。另外,Ime4基因对酵母的减数分裂也有很重要的作用。种种迹象表明,m6A修饰对生物早期性器官发育以及早期的胚胎发育至关重要。近几年的结构生物学研究表明,METTL3和METTL14会形成杂络物行使催化作用,但是生物体内的作用机制至今仍然未知。参与RNA甲基化的酶包括:
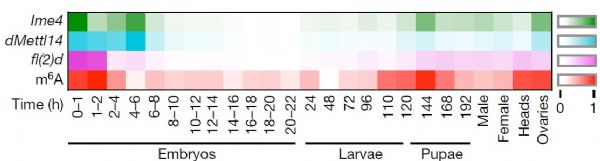
昆虫整个生命周期包括胚胎期、幼虫期(一龄幼虫→三龄幼虫)、蛹期以及成虫期。作者先检测了野生型果蝇各个时期的m6A整体的甲基化水平,使用质谱法对Ime4、dMettl14和fl(2)d三种蛋白相对表达水平做了一个热图。从热图中作者发现在胚胎早期尤其是2小时后m6A水平处于一个很高的水平,之后开始下降。在三龄幼虫期,m6A水平开始上升,在蛹期又达到了一个高峰后逐渐下降。果蝇成虫期的头部以及卵巢中m6A水平也一直维持相对较高水平。
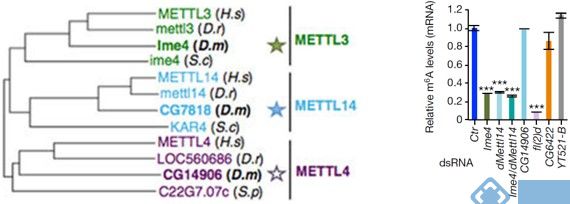
系统进化树分析表明,果蝇的METTL3同源蛋白Ime4有两种密切相关的蛋白CG7818和CG14906。在果蝇的SR2+细胞(embryonic-derived Schneider)中敲低Ime4和CG7818后,m6A水平下降70%而敲低CG14906却没有任何影响。由于CG7818与METTL14结构上具有很大的保守性和相似性,作者将CG7818重新命名为dMettl14。同样fl(2)d和Vir基因与WTAP和KIAA1429高度同源,敲低后对果蝇的m6A水平也会产生较大的影响。
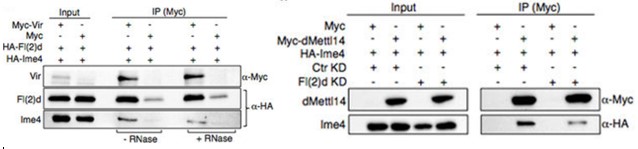
在哺乳动物尤其是人体内中,RNA甲基化转移酶METTL3和METTL14会形成杂络物,而WTAP和KIAA1429也是重要的组成部分。在果蝇甲基化转移酶中同时发现了Vir、fl(2)d和Ime4。作者对果蝇的fl(2)d敲低后,Ime4和dMettl14的interaction显著降低。
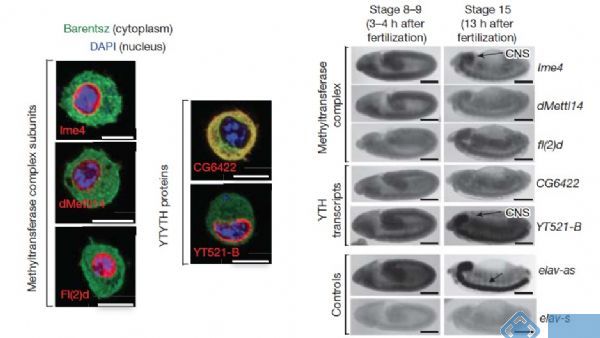
基因定位实验表明参与m6A甲基化的酶都位于细胞核内且都在胚胎早期发育阶段处于高表达水平。另外胚胎晚期,这些酶在神经外胚层也有较高的转录水平。
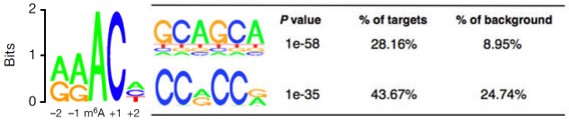
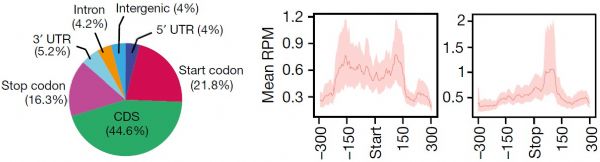
作者使用MeRIP-seq,从812个基因中鉴定了到了1120个m6A的peak。其中92%的peak都含有RRACHmotif。此外,其他类型的序列或motifs也含有较高的m6A水平,这表明这些motifs可能也对甲基化转移酶具有特异性。
此外,与其他真核生物类似,在果蝇体内start codon和stop codon区域存在很高的m6A甲基化修饰。
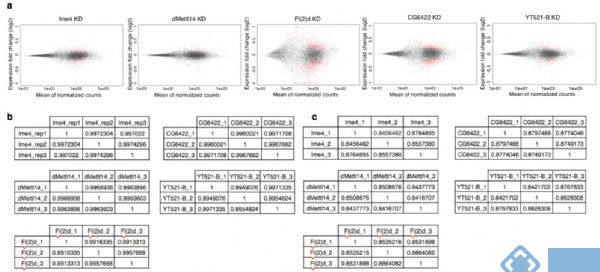
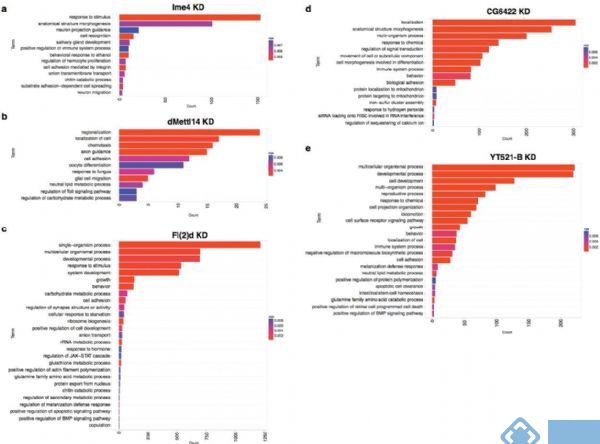
接下来,作者针对SR2+细胞系中与m6A相关的各种酶敲低后进行了转录组测序,这些酶包括Ime4、CG6422、dMellt14、YT521-B以及Fl(2)d。从上图a中可以明显看到,MA-plot显示不同敲低条件下,SR2+细胞系中的基因表达发生了显著的差异(p<0.05)。图b表示不同敲除条件下三个生物学重复基因表达的spearman相关系数表。图c则是剪切模式的spearman相关系数表。
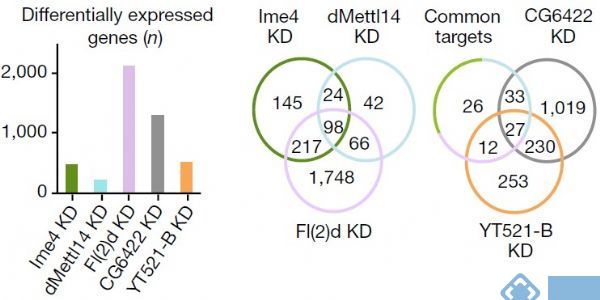
其中作者发现Fl(2)d敲低后效果最为明显,超过2000个基因表达显著差异。敲低Ime4和dMettl14后,通过上面的韦恩图可以发现SR2+中差异表达基因数量小于Fl(2)d(milder effects)。
GO功能富集分析表明,这些差异表达的基因涉及各种功能如阴离子转运、细胞粘附等。尽管SR2+细胞系并不是直接起源于神经系统,但是许多差异基因都富集到了neuronal functions上,如axon guidance和synapse activity。
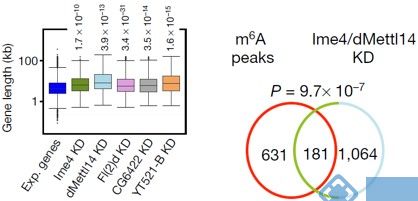
通过表达量盒形图发现,基因较低组的细胞中整体表达水平显著高于control组。接下来,对SR2+细胞系中的Ime4和dMettl14这2个基因进行双敲低(double knockdown)。韦恩图显示至少15%的基因都有m6A的peak。
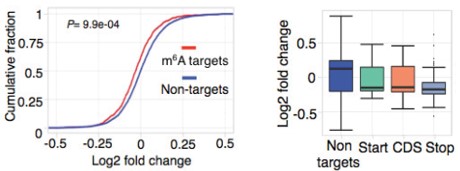
Ime4和dMettl14双敲后,m6A甲基化水平仍然发生了轻微但是仍然显著的差异。这个结果表明每个转录本可能拥有独立的m6A peak位点。
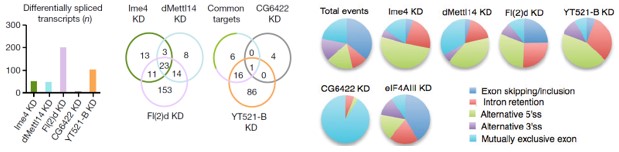
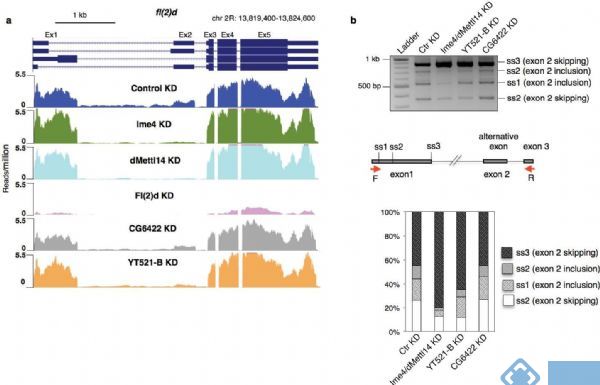
文章还发现在基因剪切事件上,双敲的结果与2种酶单独敲的结果低还是存在显著差异的。在任意一种酶的敲低实验中,fl(2)d这个基因都行使十分重要的作用。通常情况下,不同酶敲低都会对基因5’的剪切以及内含子保留等行为产生影响,这种情况同样也存在于人细胞系中。
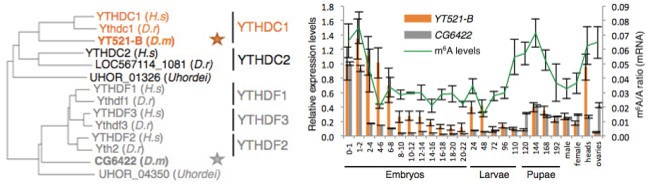
YTH家族蛋白是一种十分重要的reader酶。果蝇中,CG6422和YT521-B属于YTH家族的同源蛋白。蛋白细胞定位实验表明CG6422位于细胞质中,受精后在胚胎期2小时达到最大值,接下来持续下降并且在幼虫期和蛹期一直维持较低的水平。然而,蛋白细胞定位实验表明YT521-B位于细胞核中,并且在胚胎的神经系统已经成虫的大脑中处于较高的转录水平。
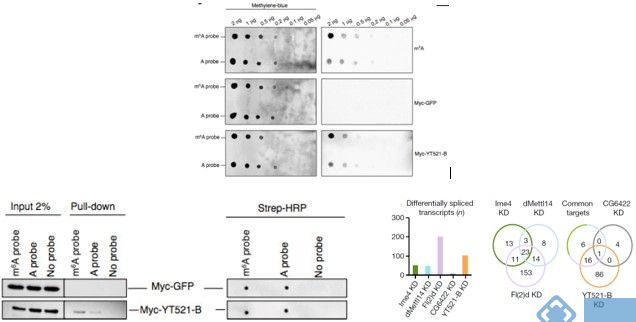
使用点印记法(dot-plot)和pull down实验表明,YT521-B能够与RNA上的m6A位点相结合。转录组测序表明,敲低CG6422后,差异基因RNA剪切事件几乎影响不大。但是敲低YT521-B后,转录组结果表明有103个基因的剪切事件差异显著。韦恩图显示YT521-B与common target以及CG6422交集不到30%。所以这些证据都表明YT521-B在pre-mRNA剪切上行使极其重要的功能。
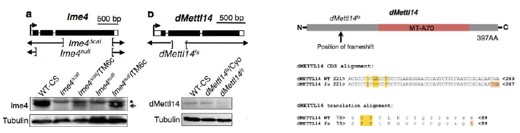
为了寻找m6A相关酶的潜在功能,作者分别构建了Ime4和dMellt14敲除的果蝇。
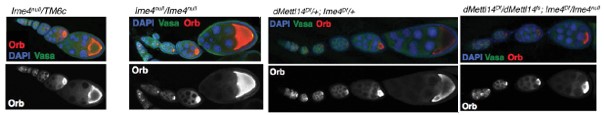
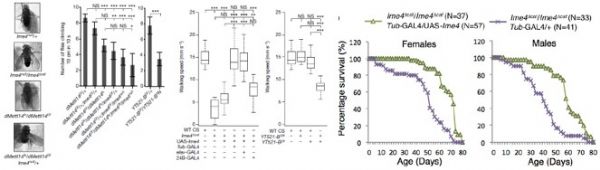
其中针对Ime4这个基因使用两种方法敲除方法,Ime4Null(CDS全部敲除)和Ime4Cat(C端保留催化结构域)。文章发现无论是纯合果蝇还是发生杂合突变的果蝇,幼虫都能羽化存活至成年期。卵巢中没有发现任何encapsulation defects。
但是突变型果蝇寿命变短,飞行和爬行受阻,无法合翅。尽管突变型果蝇能够勉强合翅伸缩翅膀,但是很难将翅膀合拢在腹部和胸部的背面。另外dMettl14基因突变型果蝇虽然翅发育正常,但是行为能力却已经缺失。为了验证Ime4和dMettl14是否在果蝇体内能够相互补偿,作者构建了双突变果蝇和单基因突变果蝇。结果表明,这2个基因功能相似调控的通路也相似,可能调控common targets。此外,Ime4似乎在功能上比dMettl14更占优势,大部分催化反应需要甲基化转移酶有特定的催