敲黑板,划重点啦~今天起,我们将与大家一起徜徉在微生物研究的海洋,希望可以为大家的微生物研究添砖加瓦。从样品的获取制备到建库测序,从常见图标的说明绘制到解读16S报告乃至如何撰写一篇高质量的16S文章……在接下来的一个月里,小编将一一为大家介绍。今天,我们先来聊一聊微生物研究中常见的热门问题吧~
1.微生物测序设置生物学重复的意义是什么?一般情况下,设置多少个重复合适?
生物学重复是指样本重复,比如3只小鼠,同时做同一个处理,就是三个生物学重复。生物学重复对于测序的实验设计以及后续信息分析都非常重要,设置生物学重复主要有以下几个作用:
1)能够消除组内误差:生物学重复可以测量变异程度;
2)增强结果的可靠性:测序的样本越多,越能够降低背景差异,从而增加结果可信度;
3)检测离群样本:异常样本的存在,会严重影响测序结果的准确性,通过后续信息分析可以发现异常样本,将其排除。
一般情况下,自然环境中(比如土壤,根系,植物等)及模式动物(比如大鼠,小鼠等)建议每组至少5个生物学重复,一般推荐10个生物学重复;若是人类肠道,粪便等样品,由于个体之间差别较大(比如环境,饮食,遗传条件,健康状态等影响),建议加大取样量,每组不少于30个生物学重复(取样少,可能会导致组内差异大于组间差异则项目无意义)。值得注意的是,如果将多个样本混在一起建库测序,多个样本则变成了一个样本,仍是无生物学重复的。
Tips:一般建议多做生物学重复,若是遇到个体之间差别较大的情况可以选择剔除个别样本,避免后期样本数量不够,后期补送重复性不好的情况发生。
2.16S 测序物种注释常用的数据库有哪些?这些数据库的特点(或优缺点)是什么?
微生态研究,是研究微生物之间以及微生物与环境之间相互关系,其主要研究对象包括真菌,细菌,古菌和病毒等。对于获得的大量16S rRNA测序序列,得到可靠的物种分类结果与全面的数据库是密不可分的。16S测序物种常用的数据库有RDP, SILVA ,Greengenes,NT-16S(NT库提取整理16S序列数据库)等,这些数据库的详细信息见下表:
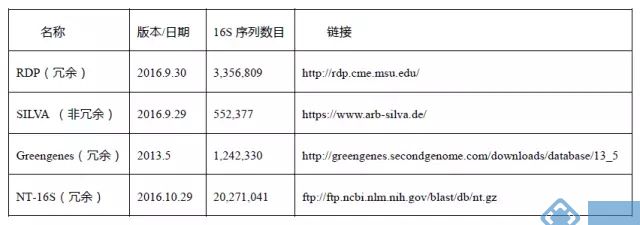
第一列为数据库名称;第二列为数据库最新版本或更新日期;第三列为数据库16S序列数目;第四列为数据库网址。
RDP数据库是目前较常用的比对、注释的参考数据库,版本更新比较快,16S序列信息较全。
SILVA 数据库由于更新比较及时,因此也是目前最常选用的参考数据库之一。
Greengenes数据库相对于RDP,SILVA数据库,长时间未更新,目前较长用于嵌合体去除的参考数据库,另外16S功能预测-PICRUST软件是基于Greengenes的gg_13_5研发的,因此想做PICRUST分析也必须依托于Greengenes数据库进行比对。
NT-16S数据库是基于NT库提取整理的16S数据库,该数据库是联川特色数据库,由于RDP数据库只能注释到属水平,基于RDP注释结果,进一步对序列进行注释,获得种水平的注释结果。
3.16S 物种分类学注释中,常得到 UNCLASSIFIED,NO_RANK,OTHERS 等意义?
虽然理论上所有的微生物序列都应当能在种甚至菌株水平得到鉴定,但由于微生物种类繁多,目前上述常用数据库还很难包罗万象。加上二代测序读长的限制,往往只能选择16S rRNA 1-3个高变区(目前常用的扩增片段V3-V4区/V4区)作为扩增片段进行测序,分类的精确性受到一定的限制(某些物种高变区也可能十分相近,能够区分它们的特异性序列片段有可能不在扩增区域内,因此在鉴别的过程中受到测序长度的限制),因此,在实际分析过程中,并非所有OTU代表序列都能获得属或种水平的分类学信息(即在对应的分类学水平尚且属于 “Unclassified”)。另外,也总是有可能遇到某些较为新奇、尚未被充分研究的微生物(在较高分类水平,比如门水平鉴定为“Unclassified”),此为正常现象。
No_Rank表示在某个分类水平上没有明确的分类信息或分类名称(与数据库有关)。
Others一般在作图时自行定义的,比如做热图或柱状图分析时,一般选择丰度较高的物种(比如丰度前20的物种)进行展示,剩下的所有物种以Others定义,且Others的丰度为剩下所有物种丰度的求和。
4.OTU 是什么?作用是什么?16S 多样性测序引物该怎么选择?
OTU(operational taxonomy unit)操作分类单元,在微生态研究中,为了便于分析,人为给定某一分类单元(品系,种,属等)设置的同一标志。简单的说,OTU类似于种,是根据高变区序列比对得出的,一般将相似度大于97%的序列聚为一类,称为同一个OTU。
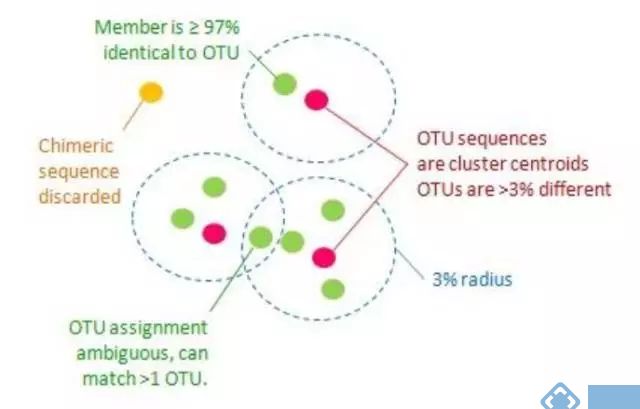
通常情况下,将来自同一环境的所有样品序列进行合并,将序列之间相似性大于97%(相当于物种分类种水平之间的序列差异)归类为一个OTU,理论上来说,每个OTU对应于一个不同的16S rDNA序列,也就是每个OTU对应于一个不同的物种。通过OTU聚类分析,不仅可以简化数据结构还可以得到样品中的微生物多样性以及不同微生物的丰度。
5.ALPHA 多样性和 BETA 多样性在微生物检测中的意义?
对群落多样性、生态多样性的研究主要应用多样性指数来进行比较,常用的指数包括alpha多样性指数和beta多样性指数。
alpha多样性是指一个特定环境或生态系统内的多样性,主要关注局域均匀生境下的物种数目,因此又称为生境内的多样性。alpha多样性常用的指数有四种:Observed species,Chao1,Shannon,Simpson。
其中Observed species指数是指样本中实际包含的OTU数目,chao1指数是指估算样本中OTU的数目,这两个指数均反映样本中OTU(物种)数目的高低,这两个指数越高表明样本中的物种丰富度越高。Shanon指数是用来描述OTU出现的紊乱和不确定性,不确定性越高,多样性指数越高,Simpson指数是指从样品中随机取两条序列,这两条序列属于不同的OTU的概率,如果样本中只有一个OTU,Simpson指数为0,多样性最低。Shannon和Simpson指数不仅反映了样本中物种的数量(即丰富度)又反映了样本中各物种的丰度分布情况(即均匀度)。总之,样品中OTU数目越多,OTU丰度分布越均匀,多样性指数越高。
beta多样性指沿环境梯度不同生境群落之间物种组成的相异性或物种沿环境梯度的更替速率,也被称为生境间的多样性,主要是衡量群落之间的差别。beta多样性的意义在于:
1)它可以反映生境变化的程度或指示生境被物种分割的程度;
2)beta多样性的高低可以用来比较不同生境的多样性。
总的来说,alpha多样性主要关注某一个群落中的物种多样性,而beta多样性主要关注不同群落之间的物种多样性差别。
6.16S 多样性测序引物该怎么选择?
传统方法中最常用的引物是27F和1492R,几乎能扩增出完整的16S rRNA基因全长序列,但是由于二代高通量测序读长的限制,该引物明显不适用于高通量测序平台。考虑到读长的限制,只能对16S rDNA某一段或某两段可变区进行测序。一般而言,环境微生物组学常用的,也是认可度比较高的测序区域,V3-V4,V4-V5,或者单个V4区。
常用的V3-V4区通用引物是338F/806R,具体序列如下:
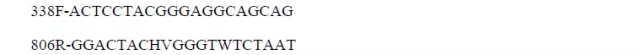
好了,16S专题第一期就到此结束了。我们整合了宏基因组测序中的部分热门问题并以此开篇,下期我们将介绍样本获取及制备的相关事宜。
想即时获取专题更新吗?
想了解更多精彩资讯吗?
想拥有更多干货吗?
扫一扫二维码,
关注“联川生物”就能实现~

