
编者按
肾脏是人体的重要器官,它的基本功能是生成尿液,借以清除体内代谢产物,同时经重吸收功能保留水份及其他有用物质,如葡萄糖、蛋白质、氨基酸、钠离子等,以调节水、电解质平衡及维护酸碱平衡。肾脏同时还有内分泌功能,生成肾素、促红细胞生成素、活性维生素D3、前列腺素、激肽等,又为机体部分内分泌激素的降解场所和肾外激素的靶器官。肾脏的这些功能,保证了机体内环境的稳定,使新陈代谢得以正常进行。
然而,随着经济的发展,肾脏相关疾病越来越多,并且药物的肾毒性也引起了科研人员的重视,因此一个能够高度模拟体内环境的体外肾脏模型将大大促进这方面研究的进展。而来源于hiPSC的肾类器官模型,包含多种肾脏中的细胞类型,尽可能地模拟了人体内肾脏的细胞结构,大大助力了肾脏相关的疾病建模、遗传研究和药物筛选等研究。
今天,我们特别关注一项于2023年8月发表在《Nature Protocols》的经典研究——Directed differentiation of ureteric bud and collecting duct organoids from human pluripotent stem cells,该研究报告了诱导人多能干细胞定向分化为输尿管芽和肾集合管类器官的培养方法。
一、研究背景
由于缺乏新的有效的肾脏疾病治疗方法,在体外建立人体肾脏组织模型是再生肾脏学研究的一个重要挑战。然而,由于器官结构和功能的复杂性,以及其发育起源来自两个不同的胚胎学群体:后肾间充质和输尿管芽(UB),从人多能干细胞(hiPSC)诱导生成肾脏组织具有高度的挑战性。诱导定向分化的技术已经发展到产生含有肾单位样结构的肾类器官;最近报道了一种高效实用的生成UB组织的方法。在这里,本文作者描述了一种详细的分步方案,用于将人多能干细胞分化为具有复杂的形态发育和分化为功能性集合管组织能力的三维UB类器官。
该方法可靠且具有重现性,具有hiPSC和类器官分化基本经验的技术人员可以很容易地采用该方法生成UB组织,而这些组织后续可用于研究人类肾脏发育、模拟疾病过程等。
二、主要研究成果
1. 将人多能干细胞诱导为UB类器官的方案
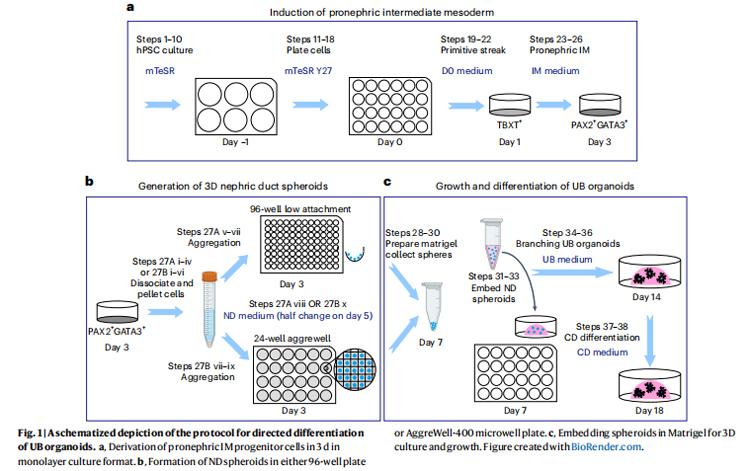
图1 定向分化UB类器官方案的示意图
研究人员采用逐步方法(如原文图1a-c所示)来模拟UB类器官生长的正常阶段。鉴于UB和后肾间充质(MM)分别起源于体内间介中胚层(IM)的前部和后部,所以在早期阶段它们的定向分化策略应该就有所不同。而胚状体,特别是包括中胚层组织,在发育过程中以头端到尾端的方式构建,其中前部IM来源于相对早期的祖细胞,而后部IM则由后期的轴向祖细胞形成。因此,从类MM前体生成肾脏类器官的方法最初依赖于延长3-6天的WNT/β-catenin激活期,以模拟后期的环境。
在本研究中,研究人员将hiPSC在含有WNT/β-catenin、FGF、BMP和TGF-β信号通路激活剂的培养基中培养1天,以诱导TBXT+中胚层前体;这些祖细胞随后通过维甲酸(RA)和FGF通路的激活以及BMP和TGF-β因子的信号传导抑制而立即分化,形成PAX2+GATA3+原肾IM细胞的效率高达90%。
2、中胚层诱导步骤持续的最佳时间为27-30 小时
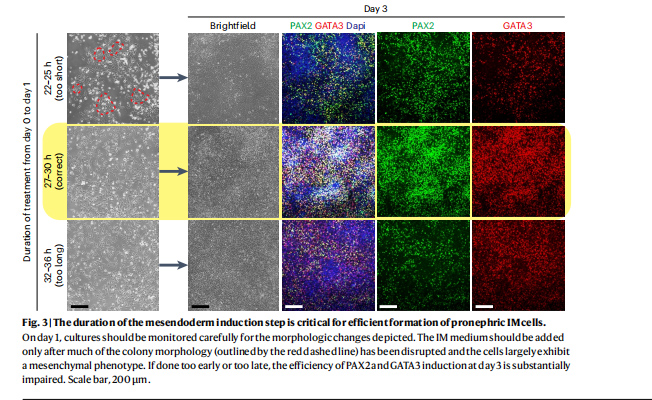
图2 中胚层诱导步骤的持续时间对于肾原IM细胞形成的影响
从第0天到第1天,通过添加含有CHIR(5 μM)、FGF2(25 ng/mL)、BMP4(25 ng/mL)和Activin A(50 ng/mL)的第0天培养基,将hiPSC诱导为间胚层祖细胞。这些祖细胞的快速有效形成对于后期成功诱导分化至关重要,仅在诱导24小时后,细胞通常不完全分散,表明它们尚未完成向中胚层状态的分化。
在27至30小时之间(通常更接近30小时),细胞已经完全分离并有间充质表型,保留最小的集落样形态,此时细胞准备进入诱导分化的下一步。若进一步延长到> 34小时也会导致后期分化效率不足。如原文图2中PAX2和GATA3染色所示。
3、三维细胞球的形成以及鉴定

图4 三维细胞球的形成
在96孔板中,最初的细胞球在第5天聚集成更大的球体,在第7天时,球体分裂成两个区域:肾小管(ND)细胞和基质间隙,见原文图4(a)。此时免疫荧光显示ND细胞球由表达PAX2和GATA3的细胞组成,见原文图4(d)。
4、UB类器官的形成及鉴定
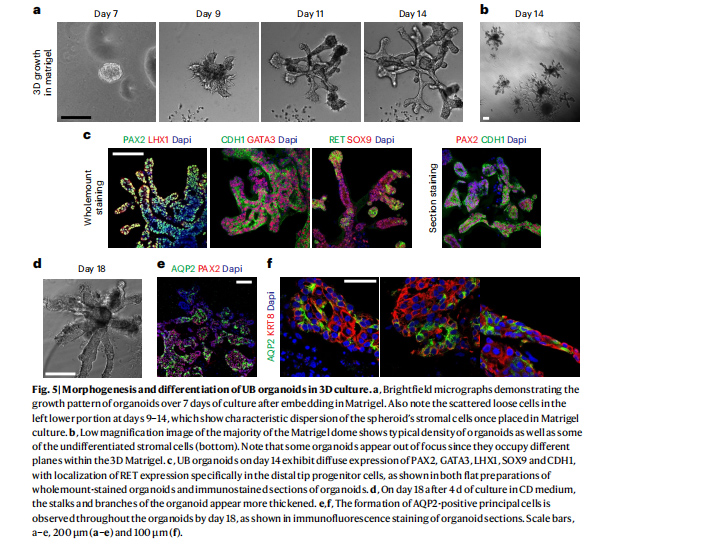
图5 UB类器官在三维培养中的形态变化
原文图5(a、b、d)为类器官在第7-18天生长形态变化的明场图片,在第9-14天左下部分也可见分散的细胞,这表明球体基质细胞在基质胶培养中具有弥散的特征。
第14天时UB类器官表现出PAX2、GATA3、LHX1、SOX9和CDH1的弥散性表达,RET由远端祖细胞特异性表达,染色图片见原文图5(c);第18天时类器官结构更加明显,明场图片见原文图5(d),通过类器官切片免疫荧光染色可观察到类器官表现出AQP2的表达,见原文图5(e、f)
5、该研究的应用
由于缺乏有效的体外人体肾脏组织模型而难以促进肾脏疾病的研究,从hiPSC生成肾脏组织及其应用一直是一个热门的研究领域。对于有hiPSC培养经验的技术人员来说,该研究的分化UB类器官的方案可靠而有效。该方案可广泛应用于实验室,促进人类肾脏的发育、先天性肾脏疾病、电解质稳态的机制和与肾小管相关的病理机制的研究。
三、编者点评
这是一项非常值得阅读的类器官研究,适合每一位想要开展“将人多能干细胞诱导为UB类器官”的学者拜读,文中提出了诱导分化过程中的详细步骤,培养基配比,并且在文末还指出了各步骤的质量控制点、可能出现的问题以及解决思路。但是本文着重于诱导分化过程中类器官各种特征的描述,并未对诱导成功的类器官进行功能学鉴定,损失了一定的指导意义。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO、智慧实验室建设、科研服务三大业务。目前,环特类器官平台已已建立多种hiPSC诱导的类器官培养平台,欢迎有需要的读者垂询!
参考文献
1. Ransick, A. et al. Single-cell profiling reveals sex, lineage, and regional diversity in the mouse kidney. Dev. Cell 51, 399–413 e397 (2019).
2. Park, J. et al. Single-cell transcriptomics of the mouse kidney reveals potential cellular targets of kidney disease. Science 360, 758–763 (2018).
3. England, A. R. et al. Identification and characterization of cellular heterogeneity within
the developing renal interstitium. Development 147, dev190108 (2020).
4. Daniel, E. et al. Spatiotemporal heterogeneity and patterning of developing renal blood vessels. Angiogenesis 21, 617–634 (2018).
5. Munro, D. A. D., Hohenstein, P. & Davies, J. A. Cycles of vascular plexus formation within the nephrogenic zone of the developing mouse kidney. Sci. Rep. 7, 3273 (2017).
6. Barak, H., Rosenfelder, L., Schultheiss, T. M. & Reshef, R. Cell fate specification along the anterior–posterior axis of the intermediate mesoderm. Dev. Dyn. 232, 901–914 (2005).
7. Taguchi, A. et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem
Cell 14, 53–67 (2014).
8. Costantini, F. Genetic controls and cellular behaviors in branching morphogenesis of the renal collecting system. Wiley Interdiscip. Rev. Dev. Biol. 1, 693–713 (2012).
9. Kobayashi, A. et al. Six2 defines and regulates a multipotent self-renewing nephron progenitor population throughout mammalian kidney development. Cell Stem Cell 3, 169–181 (2008).
10. Morizane, R. et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nat. Biotechnol. 33, 1193–1200 (2015).
11. Takasato, M. et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature 526, 564–568 (2015).
12. Tsujimoto, H. et al. A modular diferentiation system maps multiple human kidney lineages from pluripotent stem cells. Cell Rep. 31, 107476 (2020).
13. Howden, S. E. et al. Plasticity of distal nephron epithelia from human kidney organoids enables the induction of ureteric tip and stalk. Cell Stem Cell 28, 671–684 e676 (2021).
14. Mae, S. I. et al. Generation of branching ureteric bud tissues from human pluripotent stem cells. Biochem. Biophys. Res. Commun. 495, 954–961 (2018).
15. Mae, S. I. et al. Expansion of human iPSC-derived ureteric bud organoids with repeated branching potential. Cell Rep. 32, 107963 (2020).
16. Taguchi, A. & Nishinakamura, R. Higher-order kidney organogenesis from pluripotent stem cells. Cell Stem Cell 21, 730–746 e736 (2017).
17. Zeng, Z. et al. Generation of patterned kidney organoids that recapitulate the adult kidney collecting duct system from expandable ureteric bud progenitors. Nat. Commun.12, 3641 (2021).
18. Shi, M. et al. Human ureteric bud organoids recapitulate branching morphogenesis and diferentiate into functional collecting duct cell types. Nat. Biotechnol. 41, 252–261 (2023).
19. Sawada, K. & Aoyama, H. Fate maps of the primitive streak in chick and quail embryo: ingression timing of progenitor cells of each rostro-caudal axial level of somites. Int. J. Dev. Biol. 43, 809–815 (1999).
20. Parameswaran, M. & Tam, P. P. Regionalisation of cell fate and morphogenetic movement of the mesoderm during mouse gastrulation. Dev. Genet 17, 16–28 (1995).
