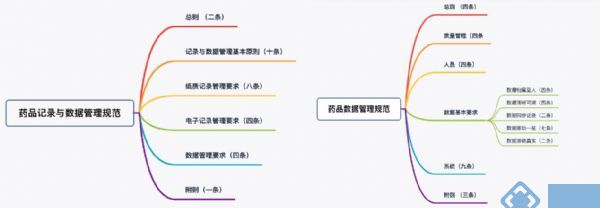
国家药监局在2020年02月25号发布了《药品记录与数据管理规范(征求意见稿)》,这是关于数据管理规范的第四版的征求意见稿。全文分六个章节,共29个条款,整篇规范的文章结构如下(见图1):
▲ 图1
相对第三版征求意见稿《药品数据管理规范(征求意见稿)》,第四版征求意见稿改动很大。
一、从文章的结构方面
《药品记录与数据管理规范(征求意见稿)》(图二) 的主体内容是第二章到第五章:记录与数据管理基本原则、纸质记录管理要求、电子记录管理要求和数据管理要求。
整篇文章围绕者记录与数据展开,就篇幅而言,在小编看来是偏重于记录的管理。《药品数据管理规范(征求意见稿)》(图三)的主体内容也是第二章到第五章,分别是质量管理、人员、数据基本要求和系统。
整篇文章从对企业管理体系的要求,人员的要求(包括管理层),数据的基本要求和系统的要求(包括产生纸质记录和电子数据的系统要求),文章的重点偏重于数据的基本要求,围绕ALCOA原则展开具体的要求。
▲ 图2 ▲ 图3
二、从文章的内容方面
就范围而言,《药品记录与数据管理规范(征求意见稿)》说的是“药品研制、生产、经营和使用活动中产生的依法需要向药品监督管理部门提供的记录与数据”;《药品数据管理规范(征求意见稿)》说的是“药品研发、生产、流通、上市后监测与评价等产品生命周期中全部活动的数据管理”。
《药品记录与数据管理规范(征求意见稿)》中的第二章节和第三章节中与记录有关的内容都是新加的内容。第三章纸质记录管理中的内容是可以参考《药品生产质量管理规范》中第八章节文件管理。
《药品记录与数据管理规范(征求意见稿)》中相对于第三版,基本删除了对于风险管理和管理层责任的要求。
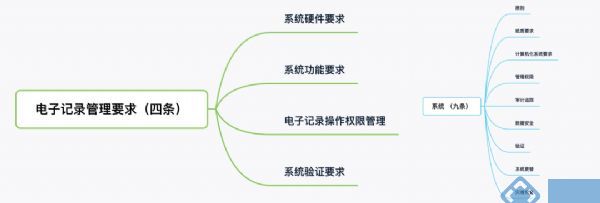
《药品记录与数据管理规范(征求意见稿)》的第四章电子记录管理要求(图三),其内容和《药品数据管理规范(征求意见稿)》中的第五章系统(图四)的内容相似,但是没有提到审计追踪和数据安全。
▲ 图 4 ▲ 图 5
《药品记录与数据管理规范(征求意见稿)》的第五章数据管理要求。只是对不同类型的数据的要求,没有像《药品数据管理规范(征求意见稿)》中第四章数据基本要求那样,从ALCOA原则的各个内容进行展开要求。