
期刊:BMC Medicine
影响因子:11.8
主要技术:scRNA‐seq,空间转录组,免疫组化
导语
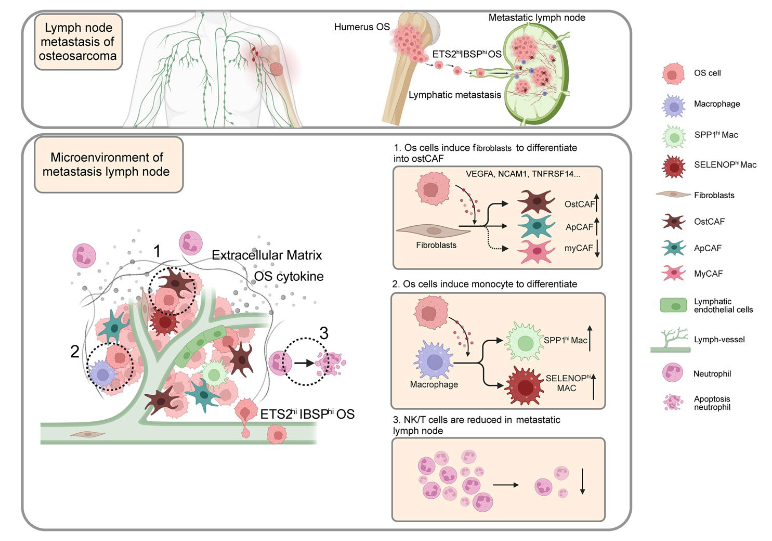
骨肉瘤 (OS) 是最常见的原发性恶性骨肿瘤,极易转移。OS 可通过淋巴管转移到淋巴结 (LN),肿瘤细胞的转移重建了 LN 的免疫景观,有利于肿瘤细胞的生长。然而,骨肉瘤 LN 转移和转移性淋巴结 (MLN) 微环境重塑的机制尚不清楚。从 18 个单细胞测序样本中,我们获得了 117,964 个细胞。拟时间分析显示,在 LN 转移过程中,成骨细胞 (OB) 细胞可能遵循从癌旁组织 (PC) →原发肿瘤 (PT) → MLN 或从 PC → PT 分化的路径。接下来,结合生生信分析、体外和体内实验以及免疫组化,确定新 ETS2/IBSP 可能会促进 LN 转移。OS 细胞可以通过与各种细胞成分相互作用来重塑 LN 的微环境,例如骨髓、癌症相关成纤维细胞 (CAF) 和 NK/T 细胞。
技术服务
scRNA‐seq,空间转录组,免疫组化
研究结果
1. 骨肉瘤单细胞图谱
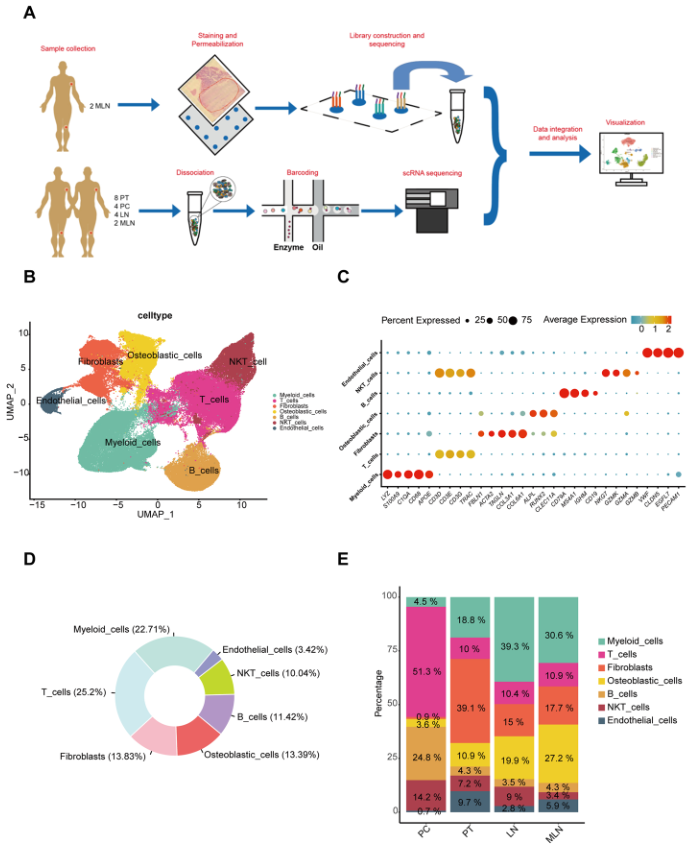
为了研究发展和转移的过程,本研究收集了 18 份样本,包括 8 例原发性肿瘤 (PT) 、4 例癌旁 (PC) 和 6 例淋巴结 (LN)。此外,为了验证 LN 中微环境的变化,对两个 MLN 进行了空间转录组测序(图 D)。经过数据质量控制,最终获得总共 117,964 个细胞,并将其分为 7 种细胞类型(图 1B)。根据标记基因表达对细胞群进行注释如下:髓样细胞 (LY Z , S100A9 , C1QA , CD68 , APOE);T 细胞 (CD3D、CD3E、CD3G、TRAC);成纤维细胞 (CAF) (FBLN1、ACTA2、TAGLN、COL3A1、COL6A1);成骨细胞 (OB 细胞) (ALPL、RUNX2 CLEC11A);B 细胞 (CD79A、MS4A1、IGHM、CD19);NKT 细胞 (NKG7, GZMK, GZMA, GZMB, CD3D, CD3E, CD3G, TRAC);内皮细胞(VWF、C AV 1、CLDN5、EGFL7、PECAM1)(图 1C)。在本研究中检测到的所有细胞中,T 细胞和髓样细胞最丰富,其次是 CAF 和 OB(成骨细胞)细胞(图 D)。OB 细胞主要分布在 MLN 和 PT 中,而 T 细胞和 NKT 细胞主要分布在 LN 中(图 1E)。
2.骨肉瘤进展过程中成骨细胞的转录特征
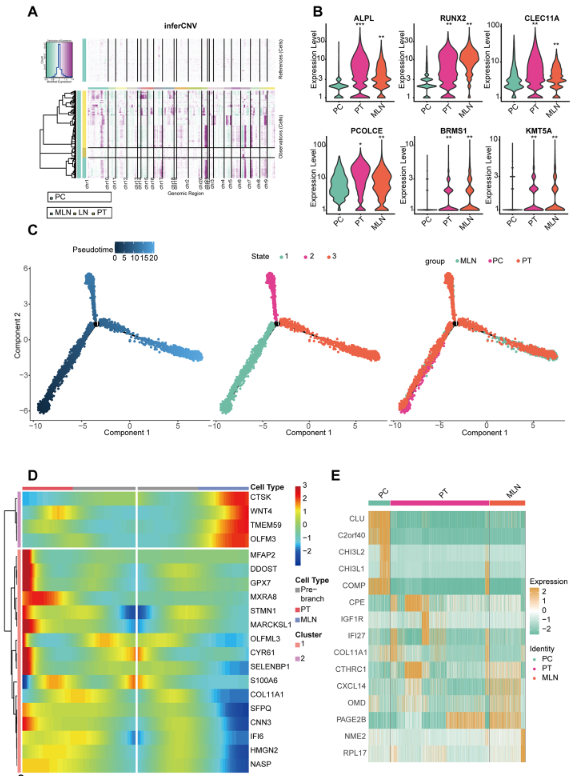
为了鉴定恶性细胞的克隆结构和细胞来源,使用 inferCNV 算法分析了 MLN、LN 和 PT 样本中 OB 细胞的 CNV 和克隆性。我们选择 PC 样本中的 OB 细胞作为参考,因为 PC 成骨细胞被认为是良性的。结果显示,PT 和 MLN 样本中的 OB 细胞在除 10 、 13 和 21 号染色体外的大多数染色体上表现出基因拷贝数增加,表明 PT 和 MLN 中的 OB 细胞是恶性骨肉瘤细胞 (OS 细胞)。相比之下,LN 中的 OB 细胞具有与参考细胞相似的拷贝数,表明它们是良性的(图 2A)。因此,PT 和 MLN 中的 OB 细胞被鉴定为恶性肿瘤细胞,即骨肉瘤细胞 (OS 细胞)。随后,我们检测了 PC、PT 和 MLN 中成骨细胞标志物的表达丰度。结果显示 ALPL 、 RUNX2 和 CLEC11A 在 PC 中低表达,而在 PT 和 MLN 中高表达 (均 p< 0.05,Wilcoxon 检验),这表明肿瘤进展过程中 OB 细胞异常激活和恶性转化 (图 2B)。我们还对患者 7 进行了拟时间分析,同时收集了 PC 、 PT 和 MLN。可以看出,患者 7 的结果与混合样本的结果相似。这表明,在 LN 转移过程中,OB 细胞可能遵循从 PC →PT → MLN(状态 3)或 PC→PT(状态 2)的分化路径(图 2)。2C,附加文件 5:图 S1)。许多基因在状态转换过程中表现出差异表达,表明这些基因可能介导 OS 的发病机制和 LN 转移 (图 2D)。此外,还介绍了各种组织中排名前 5 位的差异表达基因。这些基因可能参与 OS 的发病机制和转移,需要进一步研究 (图 2E)。
3.ETS2 通过 IBSP 介导 LN 转移
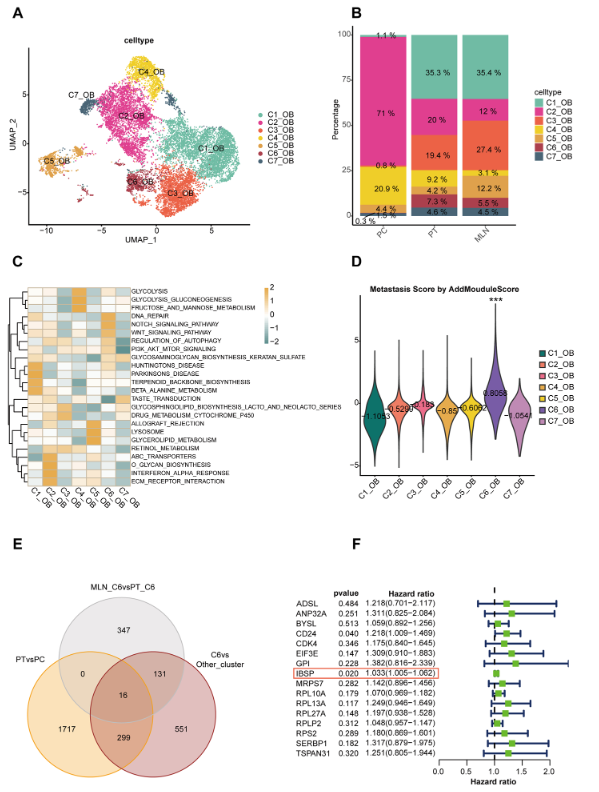
为了进一步探索转移的机制,我们将 OB 细胞细分为 7 个不同的亚组(图3A)。来自不同来源的样品中的 OB 细胞,并发现它们之间存在显著的异质性(图 D)。为了阐明 OB 细胞不同亚群的功能,我们对每个亚群的差异表达基因进行了 GSVA 分析。结果显示,C6 簇中的差异表达基因在 DNA_REPAIR、 NOTCH_ SIGNALING_PATHWAY、 WNT_SIGNALING_PATHWAY 和 PI3K_AKT_MTOR_SIGNALING 等与转移相关的通路中显著富集。C6 簇的 lls 被认为是最有可能执行迁移和侵袭功能的亚群(图 3C)。为了进一步确认 C6 亚组与 OS 转移的关联,我们编译了先前报道与 OS 转移相关的基因,并使用 AddModuleScore 使用这些基因对每个亚组进行评分。结果显示 C6 亚组得分最高,表明 C6 亚组与转移 (Fig. 3D) 关系最密切。使用 AUCell 时,类似的结果也适用(附加文件 6:图 S2C)。为了鉴定 C6 簇中的枢纽基因,我们交叉了以下三个基因集:与 PT 的 C6 相比,在 MLN 的 C6 中高度表达的基因 (MLN_C6 vs PT_C6),与 MLN 中的其他亚组相比,在 C6 中高度表达的基因 (C6 vs other_clusters),以及与 PC 的 OB 相比,在 PT 的 OB 中高度表达的基因 (PT vs PC)。获得了 16 个枢纽基因(图3E)。在 TARGET 数据库中对这些候选基因进行分析,发现只有两个基因(IBSP 和 CD24)具有显着的预后价值(图 D)。IBSP 基因编码骨唾液蛋白,该蛋白参与细胞粘附和迁移,可能与肿瘤转移有关。因此,IBSP 被认为是参与转移的 C6 亚组中的关键基因。在查阅 PROMO 数据库后,发现 ETS2 可能是调节 IBSP 的转录因子,相关性分析表明,ETS2 对 IBSP 具有调节作用,因此,我们认为 ETS2 是调节 IBSP 的潜在转录因子。
4. 验证 ETS2 通过 IBSP 在体外和体内促进骨肉瘤细胞转移
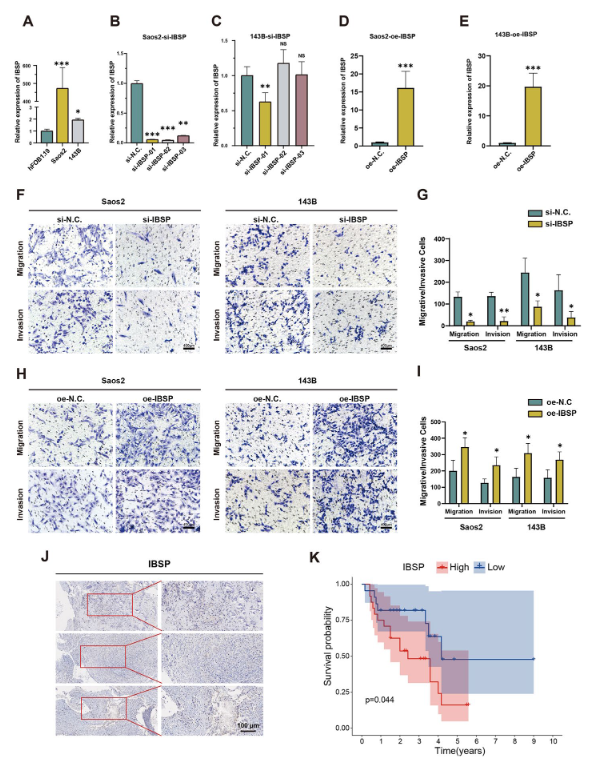
为了研究 IBSP 对肿瘤进展的影响,首先使用 RT-qPCR 检测比较了骨肉瘤细胞系 (143B, Saos2) 和正常成骨细胞 (hFOB1.19) 之间 IBSP 的表达水平,发现与 hFOB1.19 相比,IBSP 在 Saos2 和 143B 中的表达更高(图 1)。随后,我们在骨肉瘤细胞系中进行了 IBSP 和 ETS2 的沉默和过表达功能实验。在第一步中,我们设计了靶向 IBSP 的 siRNAs 过表达慢病毒载体,并在 Saos2 和 143B 细胞中进行了初步转染。结果表明,si-IBSP 01 表现出最佳的敲低效率(图 D)。4B 和 C),过表达慢病毒载体具有显著的过表达效率(图 4D 和 E)。因此,si-IBSP 01 和 IBSP 的过表达慢病毒载体被用于进一步的实验。Transwell 迁移和侵袭试验显示,IBSP 敲低显著降低了 Saos2 和 143Bcells 的迁移和侵袭能力(图 D)。4F 和 G)。相反,过表达 IBSP 显著增加了这两个细胞的迁移和侵袭能力(图 D)。4H 和 I)。随后,我们进行了免疫组织化学染色,证实了 IBSP 在骨肉瘤组织中的表达(图 D)。KaplanMeier 曲线显示,IBSP 的高表达与患者的不良预后相关 (p < 0.05) (图 4K),进一步支持 IBSP 参与肿瘤发生和进展。此外,与对照组相比,EdU 染色显示 siRNA 细胞中的细胞增殖和 EdU 掺入显著降低。
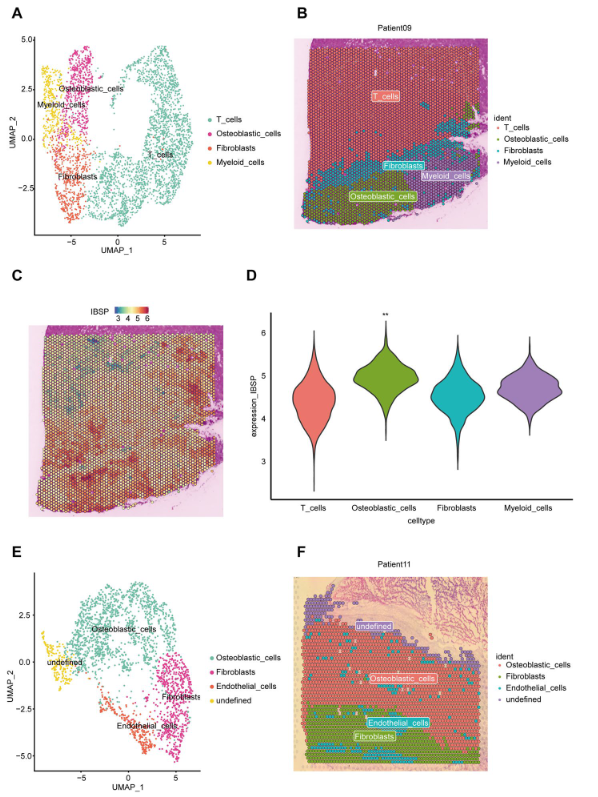
5. MLN 的空间转录组学特征
对 2 个转移性淋巴结样本进行空间转录组学分析。经过质量控制、降维和聚类,将患者 09 的斑点分为 5 个亚组。反卷积算法确定亚组 0 和 1 是 T 细胞,亚组 4 是 CAFs,亚组 4 是髓系细胞(附加文件 9:图 S5A 和 B)。亚组 2 与 AddModuleScore 算法一起被鉴定为 OB 细胞(附加文件 9:图 S5C)。在空间分布方面,OB 细胞位于 CAFs 和髓系细胞附近,这进一步证实了 OB 细胞与这两种细胞类型之间的相互作用。有趣的是,CAFs 充当屏障,分离 T 细胞,从而抑制 T 细胞对 OB 细胞的细胞毒作用(图 9A)。此外,IBSP 在 OB 细胞中高表达,这再次证实了 IBSP 高表达可能导致 LN 转移的观点(图 9B 和 C)。对于患者 11,斑点分为 5 个亚组。亚组 0 和 2 被鉴定为 OB 细胞,亚组 1 为 CAF,亚组 3 为内皮细胞(附加文件 9:图 S5D-F)。尽管患者 11 的 MLN 中没有 T 细胞和髓样细胞,但仍在 OB 附近观察到 CAFs,进一步证实了 CAFs 对 OB 的交互影响。此外,内皮细胞散布在 CAFs 和 OB 内,为肿瘤生长提供营养支持(图 9D)。
结论
骨肉瘤是一种高度恶性的肿瘤,预后不良,当 LN 转移发生时,患者的生存率会较低。大多数研究都集中在骨肉瘤的血行转移上,但很少有关于 LN 转移的具体机制的研究。同时,肿瘤细胞重塑 LN 微环境的研究几乎存在空白。因此,我们首次在单细胞水平上精确剖析了骨肉瘤中 LN 转移的分子机制。我们鉴定了 OS 细胞的转移相关亚群,并通过体外和体内实验验证了 ETS2/IBSP 信号轴在 LN 转移中的调节作用。此外,通过结合 scRNA 测序和相应的空间转录组数据,发现 OS 细胞通过与骨髓细胞(主要是巨噬细胞)和 CAF 相互作用来提高适应性,此外还发现并验证了新的信号轴 ETS2/IBSP 在骨肉瘤 LN 转移中的作用。
参考文献:
Liu Y, He M, Tang H, Xie T, Lin Y, Liu S, Liang J, Li F, Luo K, Yang M, Teng H, Luo X, He J, Liao S, Huang Q, Feng W, Zhan X, Wei Q. Single-cell and spatial transcriptomics reveal metastasis mechanism and microenvironment remodeling of lymph node in osteosarcoma. BMC Med. 2024 May 17;22(1):200. doi: 10.1186/s12916-024-03319-w. PMID: 38755647; PMCID: PMC11100118.
