使用说明:
对于用镍柱纯化大肠杆菌中His标签蛋白比较熟悉的使用者可以直接参考“4. 简化的操作流程”。否则请参考如下详细内容:
如下以最常见的大肠杆菌中表达纯化His标签重组蛋白为例,说明本产品的使用方法。在其它体系中表达时,请参考该表达体系的相关使用说明,并借鉴大肠杆菌中纯化His标签重组蛋白的使用说明。
1.大肠杆菌中可溶性His标签重组蛋白的诱导表达
如下以最常用的IPTG诱导表达系统给予说明,诱导表达条件的优化请参照所使用的诱导表达体系的详细说明。其它诱导表达系统请参考适当的使用说明进行。
a.挑取表达His标签重组蛋白的单克隆,接种到3ml或10-20ml含适当抗生素的LB培养液中,培养过夜。
b.按照1:20的比例取培养过夜的菌液,接种到预热至37℃并含适当抗生素的LB培养液中。例如取5ml培养过夜的菌液接种到100ml预热至37℃并含适当抗生素的LB培养液中。具体的培养体积视需要纯化的蛋白量而定,初步的鉴定培养3-10ml即可;常规的表达纯化,通常可考虑培养100-200ml;制备型的纯化,培养体积可以达到1L或更大。如果希望取得更好的表达效果,建议按照1:100的比例接种过夜培养的菌液,但后续培养至相应的OD值需要更长的时间。
c.37℃常规培养约30-60min或更长时间,至菌液的OD600达到0.5-0.7,并且OD600最好接近0.6。
d.加入IPTG至终浓度为1mM,继续培养4-5小时。
注:可以在加入IPTG前取出少量菌液同样培养4-5小时后作为未诱导的对照,也可以在加入IPTG前直接取出少量菌液作为未诱导的对照。对于特定蛋白的诱导表达,最佳的IPTG浓度、诱导温度、和诱导时间需要通过实验确定。
e.收集菌液至离心管中,4℃ 4,000g离心20min或4℃ 15,000g离心1min,弃上清,收集沉淀。随后即可进入细菌裂解步骤,也可以在-20℃或-80℃冻存备用。冷冻保存的菌体使用前需置于冰上解冻15min。
2.非变性条件下His标签蛋白的小量纯化:
本方法常用于小量样品的快速分析和鉴定,为后续大量制备打下基础。
a.接步骤1(e),离心收集1ml菌液的细菌沉淀并弃上清,加入100μl非变性裂解液,将细菌沉淀充分重悬于裂解液中,可进行轻微的vortex(尽量避免产生气泡)。
注:根据His标签重组蛋白表达的丰度,菌液和裂解液的体积比可以在25:1-5:1范围内适当调整。表达丰度非常高时,每毫升菌液沉淀可以加入200μl裂解液;表达丰度非常低时,每毫升菌液沉淀可以加入40μl裂解液。相关溶液的配制方法附后。本非变性裂解液可以确保裂解绝大多数可溶性蛋白和包涵体蛋白,裂解后可以直接用于SDS-PAGE。如有必要,可以在裂解细菌之前,在裂解液中添加适量的蛋白酶抑制剂混合物。
b.加入溶菌酶至1mg/ml并轻轻混匀,尽量避免产生气泡,冰水浴或冰上放置30min。
注:溶菌酶可以用裂解液配制成100mg/ml的母液,临使用前加入。溶菌酶配制成母液后,可以适当分装后-20℃保存。
c.轻轻vortex数下,以充分裂解细菌,尽量避免产生气泡。
d.4℃离心(15000g×10min),取10μl上清留样作后续检测用,收集余下上清至一新的洁净离心管中。
e.加入20μl混合均匀的50% BeyoGold™ His-tag Purification Resin,4℃在摇床上缓慢摇动30min,以充分结合带His标签的目的蛋白。
注:缓慢摇动30min已经可以确保蛋白充分结合,但可以根据时间安排的需要缓慢摇动更长时间甚至缓慢摇动过夜。经测试,直接使用50% BeyoGold™ His-tag Purification Resin也能获得良好的纯化效果。但如果希望获得更高的标签蛋白得率,可以参考步骤3f,用一个柱体积的非变性裂解液平衡BeyoGold™ His-tag Purification Resin 2-3次。平衡后,视不同的待纯化蛋白而定,待纯化蛋白的得率有可能会提高约5-20%左右。
f.4℃离心(1000g×10s)沉淀凝胶,取20μl上清留样作后续检测用,其余上清弃去。
g.加入40μl非变性洗涤液重悬凝胶,4℃离心(1000g×10s),取20μl上清留样作后续检测用,其余上清弃去。
h.重复步骤g,再进行一次洗涤。
i.加入20μl非变性洗脱液,轻轻重悬凝胶。4℃离心(1000g×10s),收集上清及凝胶。上清即为纯化获得的带有His标签的目的蛋白。
j.重复步骤i两次。共洗脱收集约60μl纯化的蛋白样品。
3.非变性条件下His标签蛋白的大量纯化:
a.接步骤1(e),对于新鲜的或解冻的细菌沉淀,按照每克细菌沉淀湿重加入4ml(2-5ml均可)非变性裂解液的比例加入裂解液,充分重悬菌体。如有必要,可以在裂解细菌之前,在裂解液中添加适量的蛋白酶抑制剂混合物。
b.加入溶菌酶至终浓度为1mg/ml并混匀,冰水浴或冰上放置30min。
注:溶菌酶可以用裂解液配制成100mg/ml的母液,临使用前加入。溶菌酶配制成母液后,可以适当分装后-20℃保存。
c.冰上超声裂解细菌。超声功率200-300W,每次超声处理10s,每次间隔10s,共超声处理6次。
注:具体超声处理的方式须根据特定型号的超声仪器自行摸索和优化。
d.(可选做)如果超声处理后裂解液非常粘稠,可以加入RNase A至10μg/ml及DNase I至5μg/ml,冰上放置10-15min。或者也可以使用适当的装好了较细针头的注射器,反复抽吸数次,以剪切粘稠的基因组DNA等。
e.4℃ 10,000g离心20-30min,收集细菌裂解液上清并置于冰水浴或冰上。可以取20μl上清留作后续检测用。
注:上清必须保持澄清,即不含任何不溶物,才能进行下一步的纯化。上清中如果混有不溶性杂质会严重影响后续纯化获得蛋白的纯度。
f.取1ml混合均匀的50% BeyoGold™ His-tag Purification Resin,4℃离心(1000g×10s)弃去储存液,向凝胶中加入0.5ml非变性裂解液混匀以平衡凝胶,4℃离心(1000g×10s)弃去液体,再重复重复平衡1-2次,弃去液体。将约4ml细菌裂解液上清加入其中,4℃在侧摆摇床或水平摇床上缓慢摇动60min。
注:BeyoGold™ His-tag Purification Resin也可以不平衡直接使用,但蛋白的得率有可能会有5-20%的下降。
g.将裂解液和BeyoGold™ His-tag Purification Resin的混合物装入试剂盒提供的亲和层析柱空柱管中。
注:也可先取1ml混合均匀的50% BeyoGold™ His-tag Purification Resin装柱,然后用0.5ml非变性裂解液平衡2-3次后加入约4ml细菌裂解液上清,后续可以把穿流液收集后重复上柱3-5次以充分结合目的蛋白。先混合后装柱的方式操作起来相对麻烦一些,但更有利于带有His标签重组蛋白与镍柱的充分结合,特别是当His标签被蛋白本身部分遮挡或His标签重组蛋白浓度很低时与镍柱的结合效率会高一些。
h.将纯化柱底部的盖子打开,在重力作用下使柱内液体流出,收集约20微升穿流液作后续分析用。
i.洗柱5次,每次加入0.5-1ml非变性洗涤液,每次均收集约20微升穿柱的洗涤液用于后续的分析检测用。洗柱及下一步洗脱过程中可以用Bradford法简单快速地检测每次洗涤液和洗脱液中的蛋白含量,从而考虑增加或减少洗涤和洗脱的次数。
注:如果出现后续获得蛋白纯度不够高的情况,可以再增加洗柱次数2-3次。
j.洗脱目的蛋白6-10次,每次用0.5ml非变性洗脱液洗脱。将每次的洗脱液分别收集到不同的离心管中。收集获得的洗脱液即为纯化的His标签蛋白样品。蛋白纯化效果可以参考图1。
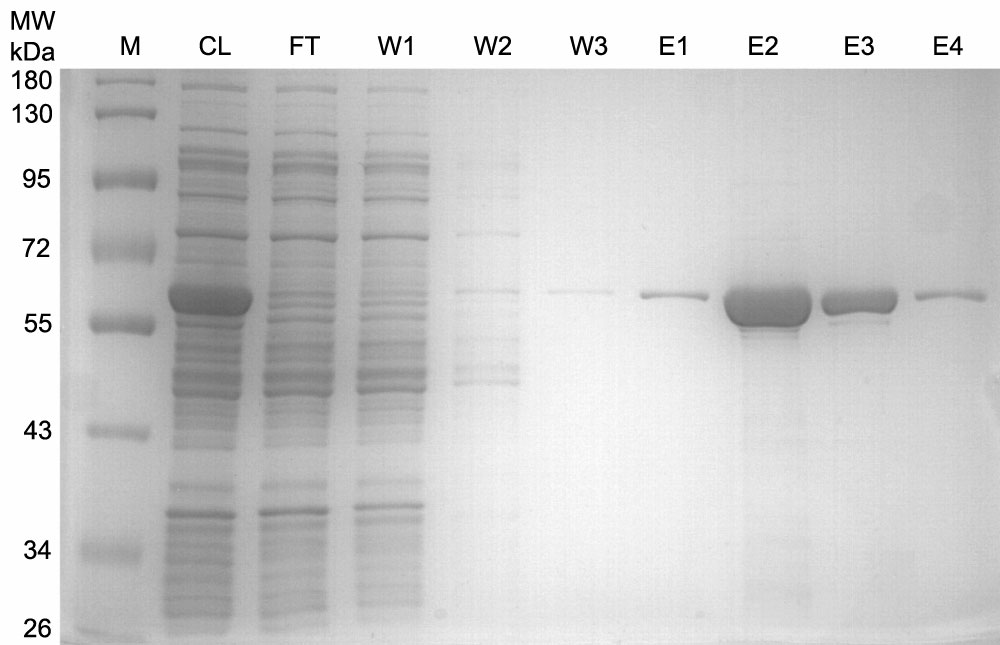
图1. His标签重组蛋白纯化效果图。M: marker; CL:细菌裂解液(cell lysate);FT:上样穿流液(flow through);W1-W3:洗涤液1-3 (wash 1-3);E1-E4:洗脱液1-4 (elution 1-4)。注:实际的电泳结果会因样品、上样量等的不同而有所不同。
4.简化的操作流程:
a.细菌中的目的蛋白诱导表达后,离心沉淀细菌。
b.每克细菌沉淀湿重加入4ml非变性裂解液,可添加适量蛋白酶抑制剂,充分重悬细菌。
c.加入溶菌酶至终浓度为1mg/ml并混匀,冰水浴或冰上放置30min。
注:溶菌酶可以用裂解液配制成100mg/ml的母液,临使用前加入。溶菌酶配制成母液后,可以适当分装后-20℃保存。
d.冰上超声裂解细菌,离心取上清。
e.BeyoGold™ His-tag Purification Resin装柱,1ml非变性裂解液平衡纯化柱2次。
f.步骤4d中的上清上柱。
注:上清上柱是可以收集穿流液并重复上柱3-5次,以充分结合His标签蛋白。
g.用0.5ml非变性洗涤液洗柱5次。
注:如果出现咪唑浓度偏低的情况,可以自行添加适量咪唑,如果出现咪唑浓度偏高的情况,可以使用试剂盒提供的非变性裂解液作为洗涤液使用。
h.用0.5ml非变性洗脱液洗脱6-10次。
注:通常该洗脱条件会比较理想。如果出现洗脱效果欠佳的情况,可以自行提高咪唑浓度至100-250mM。
常见问题:
如果纯化不成功,可以对纯化过程中收集的每个组分进行SDS-PAGE电泳检测,分析其原因。
蛋白无法与BeyoGold™ His-tag Purification Resin结合
1.测序检查基因序列的读码框是否正确。
2.尝试将标签加在蛋白的另一端。
3.增加BeyoGold™ His-tag Purification Resin与蛋白结合时间(如4℃过夜)。
4.如果使用预装柱,可收集裂解液上柱后的穿流液并多次重复上柱。
5.检查所有缓冲液和溶液的pH值是否正确。
6.确认体系中所用各种试剂的浓度在镍柱的耐受范围以内。
7.降低结合缓冲液中的咪唑浓度。
目的蛋白被洗涤液洗脱
1.降低洗涤液中的咪唑浓度或者稍微提高其pH值。
2.检查洗涤液的pH和成分。
3.确认洗涤液中各种试剂的浓度在耐受范围内。
蛋白在纯化过程中形成沉淀
1.将纯化温度控制在室温。
2.加入去垢剂,如0.1% Triton X-100或者Tween-20。
蛋白无法洗脱
1.用梯度pH及咪唑洗脱,确定最优洗脱条件。
目的蛋白与其它蛋白共同洗脱
1.提高结合缓冲液和洗涤液中的咪唑浓度。
2.降低BeyoGold™ His-tag Purification Resin的使用量。
3.加入DTT或β-巯基乙醇打开二硫键。
4.增加盐或者去垢剂浓度,或者向洗涤液中加入乙醇或甘油以降低非特异相互作用。
5.检查基因内部是否含有起始密码子(C端标记蛋白)或者提前终止位点(N端标记蛋白)。
