题目:Site-Specific Fucosylation Analysis Identifying Glycoproteins Associated with Aggressive Prostate Cancer Cell Lines Using Tandem Affinity Enrichments of Intact Glycopeptides Followed by Mass Spectrometry
期刊:Anal Chem
影响因子:6.38
主要技术:完整N-糖肽定性和定量分析
研究背景
蛋白质的糖基化是重要功能蛋白质修饰之一,在多种细胞过程中起着至关重要的作用,例如细胞粘附,受体活化,肿瘤浸润,转移和炎症反应。1-4岩藻糖基化(Fuc),尤其是核心Fuc分支是最常见的基于糖基化的修饰之一,据报道与癌症和炎症等疾病的发展有关。研究表明,正常、良性肿瘤、癌症以及其他疾病生物学样品中的Fuc含量不同。核心Fuc糖蛋白已被用作临床诊断中的生物标志物,α胎蛋白的核心Fuc糖型(AFP-L3)已获得FDA批准作为肝细胞癌的诊断性生物标志物。
在这项研究中,作者开发一种方法,富集完整的Fuc糖肽来分析Pca细胞中糖基特异性岩藻糖基化修饰,用于评估各种Fuc结合凝集素的特异性,探究岩藻糖化修饰对前列腺癌侵袭转移的作用机制,为新的标志物发现和治疗指出新的方向。
实验思路
实验结果
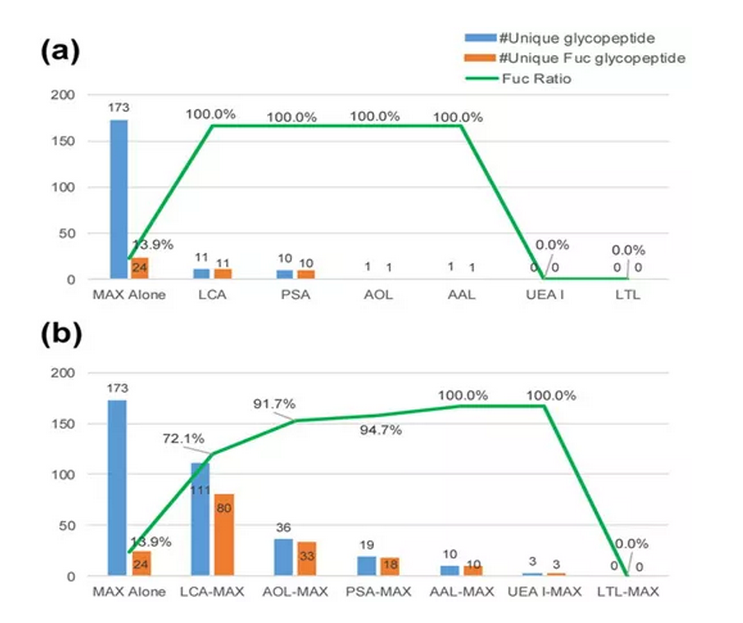
01Fuc糖肽的富集策略评估
凝集素对糖链有很好的富集作用,但当凝集素单独用于富集复杂样品中的糖肽时,可能会发生非特异性结合。Oasis MAX是一种基于亲水性的强阴离子交换色谱柱,具有很高的效率。为了评估和确定Fuc糖肽的最佳富集策略,作者分别以六种凝集素(LCA,PSA,AAL,LTL,UEA I和AOL)及六种凝集素串联Oasis MAX亲和柱进行检测。以比较不同富集方法对岩藻糖糖肽的富集效率。
与单独使用Oasis MAX富集相比,凝集素富集可以提高已鉴定的Fuc糖肽与总糖肽的比率(图1a)。此外,尽管某些凝集素中Fuc糖肽的比例略有下降,但凝集素—Oasis MAX的富集可显着增加已鉴定的完整糖肽的数量(图1b)。根据这些结果,我们得出结论,在富集Fuc糖肽时,先用凝集素,然后用MAX进行串联富集比单独使用MAX和单独使用凝集素更好。
图1不同富集策略鉴定结果
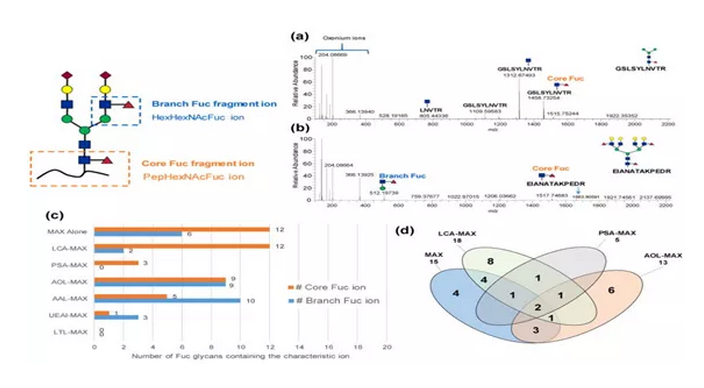
02完整Fuc糖肽凝集素亲和富集的特异性
随后,作者分析了岩藻糖在糖链中的位置,核心Fuc和支链Fuc的特征离子用于研究凝集素-Oasis MAX样品中凝集素对核心或支链Fuc的特异性。通过对核心和支链Fuc的代表性光谱以及被不同凝集素富集的每个特征离子的Fuc聚糖的数量分析,结果表明,LCA和PSA优先与核心Fuc结合,而AOL,AAL和UEA I对Fuc聚糖表现出广泛的特异性。
接下来,作者考虑了对核心Fuc的结合能力和特异性,分析了使用LCA-MAX,PSA-MAX,AOL-MAX和MAX单独富集的已鉴定Fuc聚糖的数量(图2-d)。结果也表明LCA和PSA对核心Fuc具有相似的特异性。
图2 Fuc糖肽的凝集素特异性结果
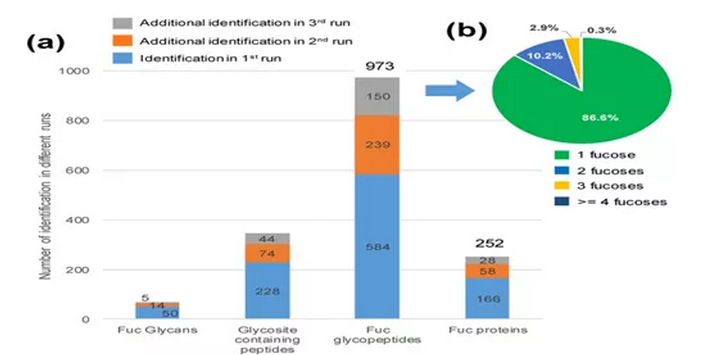
03通过LCA-MAX对Pca细胞的Fuc糖肽进行大规模分析
根据上述结果,我们选择LCA-MAX串联富集的方法,对四种Pca细胞系中的核心Fuc糖蛋白组进行富集,随后进行TMT标记,以定量分析来自四个不同细胞系的Fuc糖肽。
从四个Pca细胞系中鉴定了252个独特Fuc蛋白,973个独特的完整Fuc糖肽(参见图4a)。并对同一糖肽上岩藻糖修饰的个数进行了分析,发现大多数Fuc糖肽上只有一个岩藻糖化修饰。
图3 从四个Pca细胞系大规模分析Fuc糖蛋白组的结果
04侵袭性(AG)和非侵袭性(NAG)Pca细胞系中差异表达的Fuc糖肽
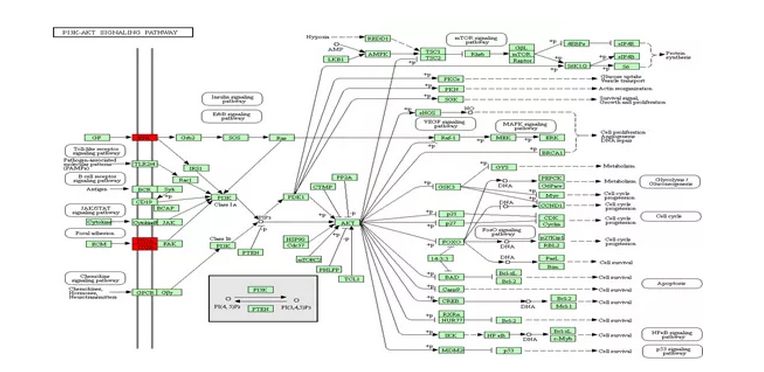
接着,研究者使用TMT报告标签计算在不同样品(细胞系)中鉴定出的Fuc糖肽的比例,从26种Fuc蛋白中鉴定出51种Fuc糖肽,发现它们与NAG细胞系相比在AG中表达上调。为了深入了解这些差异表达的Fuc蛋白的生物学影响,我们对我们的结果进行了(KEGG)Mapper途径分析。KEGG分析显示,这些蛋白质与ECM-受体相互作用,PI3K-AKT信号传导途径和粘着斑的途径有关。通过ECM-受体相互作用途径,AG细胞系中来自整合素α-2(α2),整合素α-3(α3)和整合素β-1(β1)的13个Fuc糖肽被上调。
整合素蛋白是促进细胞-细胞外基质(ECM)粘附的跨膜受体,其岩藻糖化修饰增加,能促进肿瘤细胞迁移;表皮生长因子受体(EGFR)已被证明在包括前列腺癌在内的多种癌症的转移中起关键作用,与NAG细胞相比,在AG细胞中被高度岩藻糖基化;最后,我们鉴定了三种源自天冬氨酰/天冬酰胺基β-羟化酶(HAAH)的过表达Fuc糖肽,其中之一在AG和NAG之间有明显差异。这些结果共同表明,岩藻糖化修饰增加在肝癌侵袭活性中起着重要的功能作用。
图4 KEGG信号通路分析
总结与讨论
在这项研究中,我们建立了选择性富集核心Fuc糖肽的策略,并评估了NAG和AG Pca细胞系之间岩藻糖基化分布的变化。我们首先说明了串联凝集素和MAX柱对Fuc糖肽的富集是最佳的。接下来,我们探索了与岩藻糖结合的凝集素的特异性,显示LCA,PSA和AOL的结合能力强于AAL,LTL和UEAI。此外,LCA和PSA特异性结合了核心Fuc,而AOL,AAL和UEA对Fuc聚糖表现出广泛的特异性。在这些凝集素中,LCA是富集核心Fuc糖肽的最佳凝集素,并在我们的串联富集策略中用于描述NAG和AG Pca细胞系的Fuc糖蛋白组。我们的研究不仅确定了Fuc结合凝集素的特异性,而且建立了串联Fuc糖肽富集的工作流程,阐述了岩藻糖化修饰对前列腺癌侵袭转移的作用机制,为新的药物研发和肿瘤标志物的筛选提供了新的思路。
金开瑞糖基化修饰鉴定
糖基化是在酶的控制下在蛋白质或脂质上附加糖类的过程,起始于内质网,结束于高尔基体。在糖基转移酶作用下将糖转移至蛋白质,和蛋白质上的氨基酸残基形成糖苷键,并在糖基转移酶和糖苷酶的剪切、加工下形成各种类型的糖链。
糖基化蛋白质组学的核心任务是利用组学的手段,从全局上去寻找发生糖基化修饰的位点,解析糖链的结构,鉴定完整的糖肽,探索糖蛋白在生命活动中扮演的角色和生物学功能。
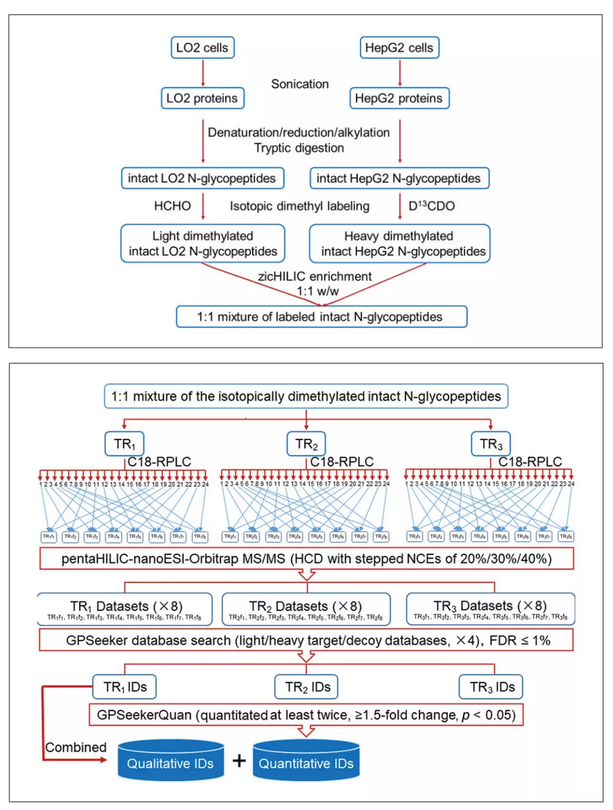
基于GPSeeker软件的-糖基化修饰鉴定
(图片引自Site- and Structure-Specifific QuantitativeN-Glycoproteomics UsingRPLC-pentaHILIC Separationand the Intact N-Glycopeptide SearchEngine GPSeeker)
优势小结
基于GPSeeker软件的-糖基化修饰鉴定
1、除了能够确定蛋白发生糖基化修饰的位点外,还能依赖开发的”GPSeeker”搜库软件对该位点发生糖基化修饰的糖链结构进行分析;
2、能知道发生糖基化修饰位点上的完整糖链信息;
3、基于完整N-糖肽液-质联用分析特征所发展稳定同位素标记可实现疾病差异表达糖基化的相对和绝对定量。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5869)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6668)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7881)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5780)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4622)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:6095)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:10091)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6901)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5359)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5886)