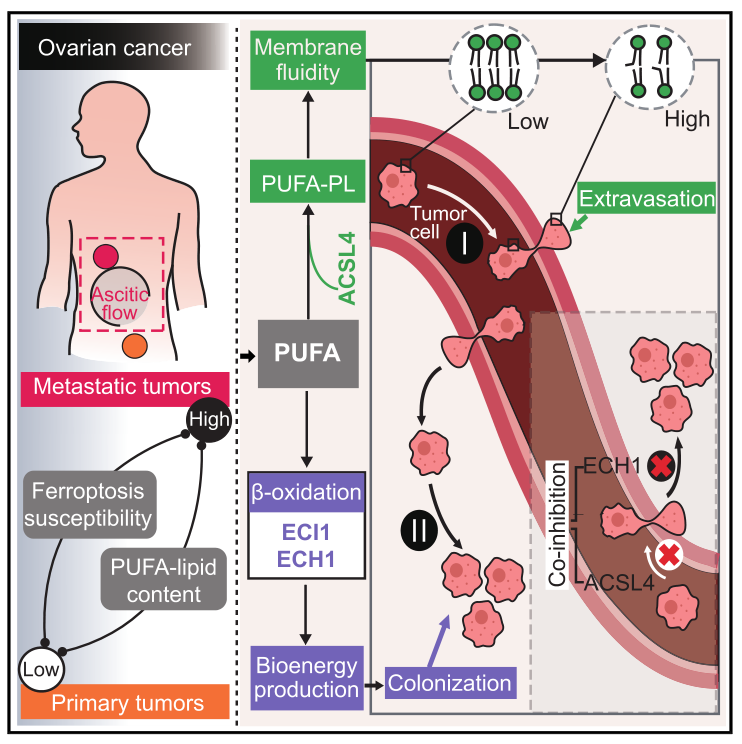
肿瘤转移是指癌细胞从原发部位通过不同途径转移到身体其它组织器官,并形成新的病灶的过程。肿瘤转移是大多数癌症相关死亡的主要原因。在卵巢癌病例中,循环癌细胞首先从血流、淋巴血管或腹膜液中的流体环境中渗出,到达远端器官。由于高机械应力等原因,转移性外渗是一个低效的过程,只有一小部分癌细胞成功侵入目标组织实质。然而,作为细胞最基本的、组成成分的脂质在支持癌细胞外渗的特性仍然知之甚少。
2024年11月,西湖大学邹贻龙、王曦团队合作,在国际顶尖学术期刊 Cell 上发表了题为:ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization 的研究论文。该研究揭示了多种癌症的转移潜能和铁死亡易感性之间的相关性,转移的癌细胞具有更高的铁死亡敏感性和多不饱和脂肪酸脂质(PUFA-Lipid)含量。长链酯酰辅酶A合成酶(long-chain acyl-CoA synthetase, ACSLs)属于多基因家族编码的酶,是机体内脂肪代谢的关键酶,主要催化12~20个碳链长度的脂肪酸,三磷酸腺苷和辅酶A形成长链酰基辅酶A。ACSL4是ACSL家族中的一员,参与对花生四烯酸和二十碳五烯酸的调控。本研究发现ACSL4通过增强膜流动性和细胞侵袭性促进转移性外渗,还通过促进多不饱和脂肪酸(PUFA)向酰基辅酶A(acyl-CoA)的酯化发挥促进铁死亡的作用。该研究还发现,多不饱和脂肪酸脂质在促转移的同时,依赖ECH1等限速酶,共抑制ACSL4和ECH1,可有效抑制肿瘤转移。这项研究不仅揭示了癌症转移的新机制,还为开发靶向肿瘤转移的新型药物奠定了基础。
技术路线图
1. 肿瘤转移潜能与铁死亡敏感性之间的相关性
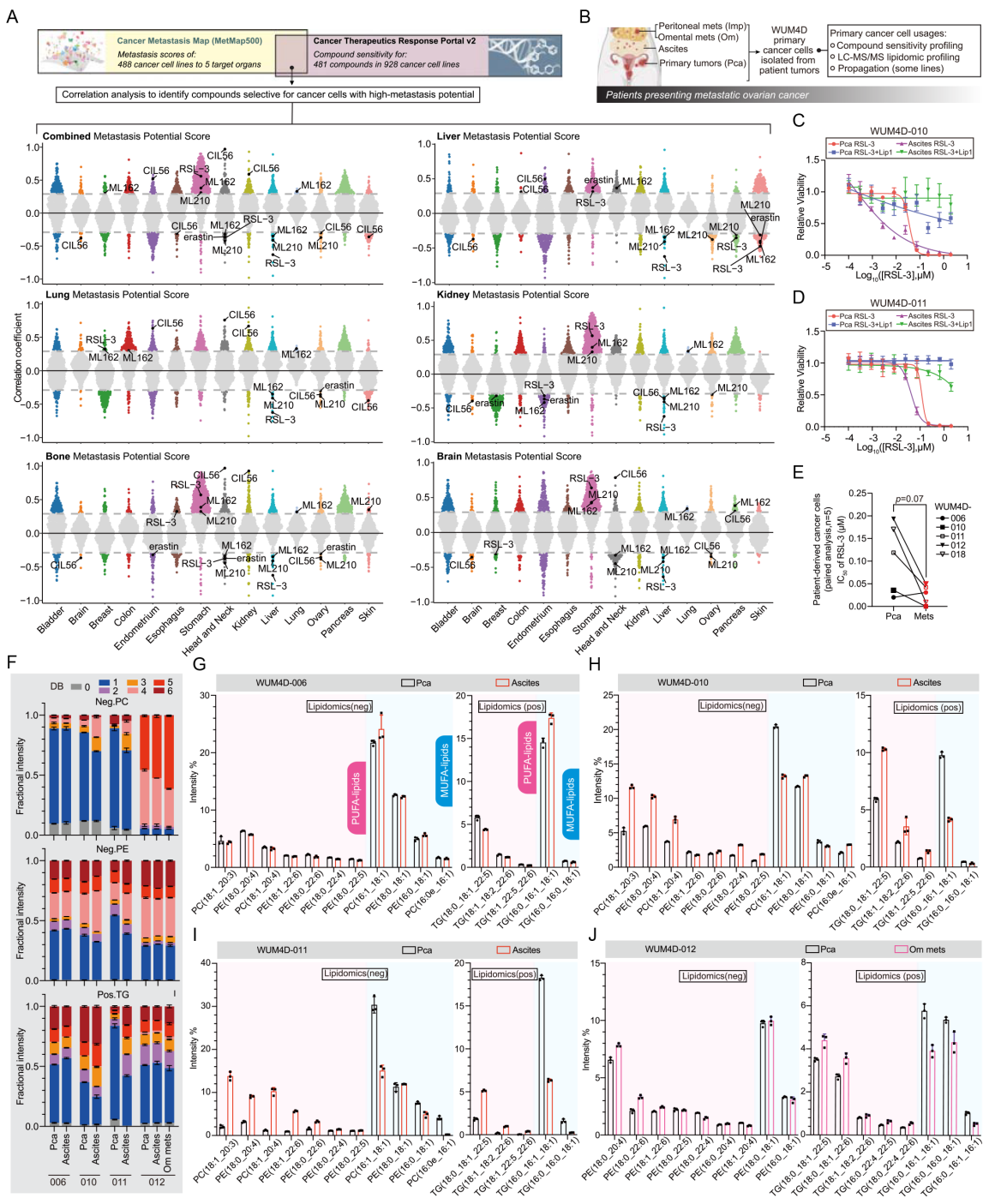
利用 MetMap 数据库和 CTRP 数据库来评估癌细胞系的转移潜能及其对铁死亡诱导剂的敏感性之间的关系,结果发现具有高转移潜能的卵巢癌、肝癌和头颈癌细胞系对铁死亡诱导剂更敏感。进一步利用临床样本分离原代癌细胞,通过体外实验发现来自腹水或网膜的肿瘤细胞比原发肿瘤细胞对铁死亡更敏感。随后采用液相色谱-串联质谱 (LC-MS/MS) 技术分析了卵巢癌细胞中的脂质成分,发现转移性肿瘤细胞中多不饱和脂肪酸(PUFA)显著增加,表明脂质代谢在肿瘤转移中发挥重要作用。
图1. 肿瘤转移潜能与铁死亡敏感性之间的相关性
2. 卵巢癌转移模型构建
从MetMap数据库中筛选出了具有高转移潜能和高铁死亡敏感性的卵巢癌细胞系ES-2来构建模型,进一步通过重复体内筛选,从肝脏和肺组织中分离出具有高转移能力的ES-2细胞克隆,命名为ES-2-MC1-Hep和ES-2-MC1-Lung。铁死亡诱导剂处理之后发现,两种细胞对诱导剂的敏感性更高。脂质组学的研究进一步发现,ES-2-MC1-Lung细胞中PUFA含量升高,尤其是含有C20:4和C22:6侧链的磷脂酰乙醇胺(PEs)。
3. 构建体内基因筛选模型
通过两轮体内筛选,从小鼠肝脏中筛选出具有高转移效率的ES-2-MC2-Hep细胞。利用靶向288个磷酸酶的CRISPR sgRNA文库进行了遗传筛选,成功地识别了多个候选的肺脏转移抑制基因(PTPRG和PTPN3)和促进基因(PPA1和PPP2R1A)。
图2. 构建卵巢癌高效转移模型
4. NMNAT1和ACSL4是调控卵巢癌转移的关键基因
通过体内CRISPR筛选,发现NMNAT1、HADHB、PTPRG和ATP6V1H与肝脏和肺转移相关。其中NMNAT1介导NAD生物合成并参与各种原发癌症的进展,敲除NMNAT1可以抑制卵巢癌肝脏和肺转移。随后又利用CRISPR-Cas9技术敲除和回补实验发现,ACSL4参与脂肪酸代谢,敲除 ACSL4 可以抑制卵巢癌肺转移。
图3. NMNAT1和ACSL4是调控卵巢癌转移的关键基因
5. ACSL4促进癌细胞外渗
免疫荧光分析显示,静脉内植入ES-2-MC2-HEP-sgACSL4细胞形成的转移灶更少、更小。为了进一步阐明ACSL4的外渗作用,使用ACSL4药理学抑制剂PRGL493对癌细胞进行预处理,并对荷瘤小鼠进行持续治疗,结果发现PRGL493治疗可减轻肺实质灌注后的癌细胞负荷,说明ACSL4在癌细胞转移中的外溢出中起重要作用。接下来进一步研究发现敲除ACSL4可以降低细胞膜的流动性和细胞的侵袭能力。通过ARA(花生四烯酸)预处理,提高了ES-2-GFP-Luc亲代细胞的PUFA脂质含量,增加了静脉植入后小鼠的肿瘤转移外渗率。表明ACSL4和PUFA可能通过增强转移性癌细胞的膜流动性和侵袭性促进转移性外渗。
图4. ACSL4促进癌细胞外渗
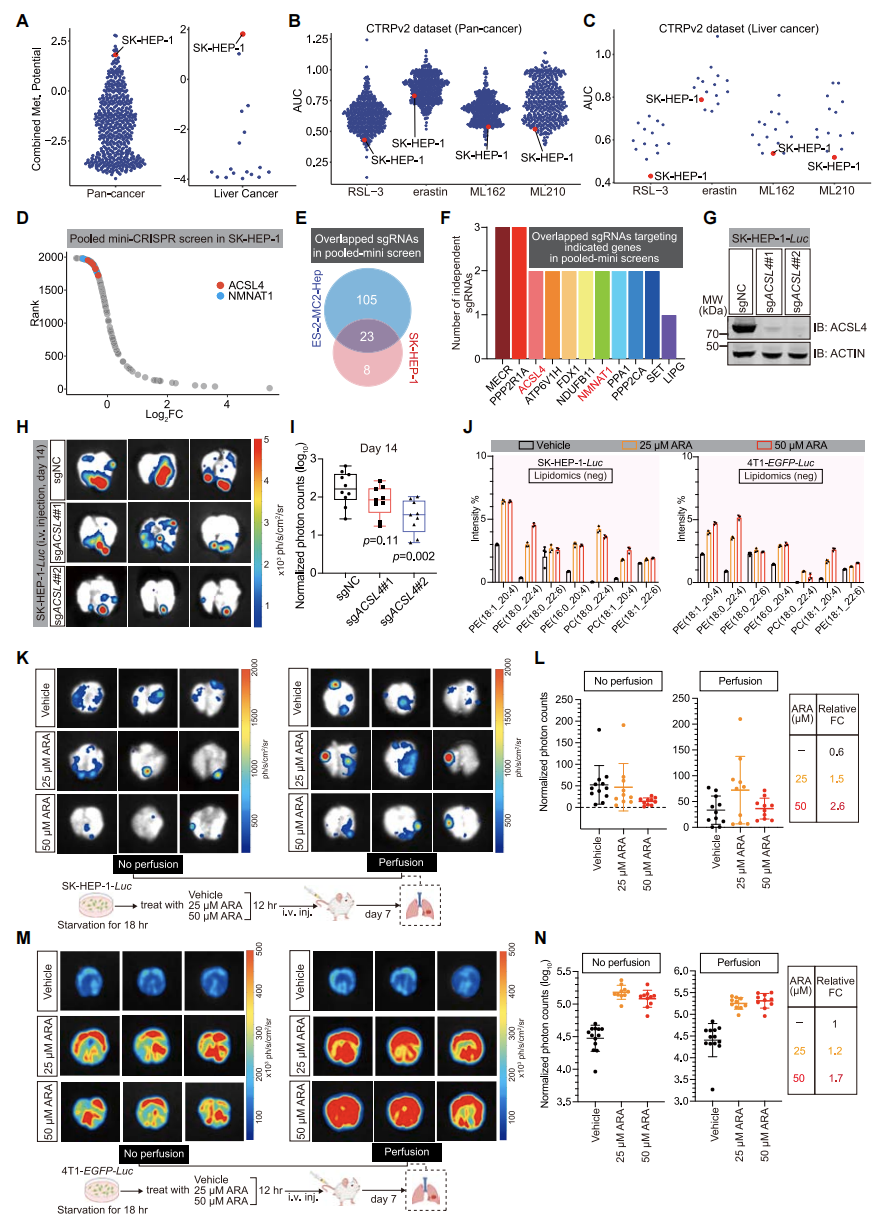
6. ACSL4的促转移作用不仅仅局限于卵巢癌
除了卵巢癌细胞系 ES-2-MC2-Hep外,使用了肝癌细胞系SK-HEP-1和乳腺癌细胞系4T1也进行了体内CRISPR筛选,结果发现,ACSL4是促进肺转移的最重要靶点基因之一,且敲除ACSL4可以抑制SK-HEP-1细胞的肺转移。通过ARA提高细胞中的多不饱和脂肪酸水平可以促进SK-HEP-1和4T1细胞的肺转移。说明ACSL4在其他癌症转移过程中或具有功能普适性。
图5. ACSL4的促转移作用不仅仅局限于卵巢癌
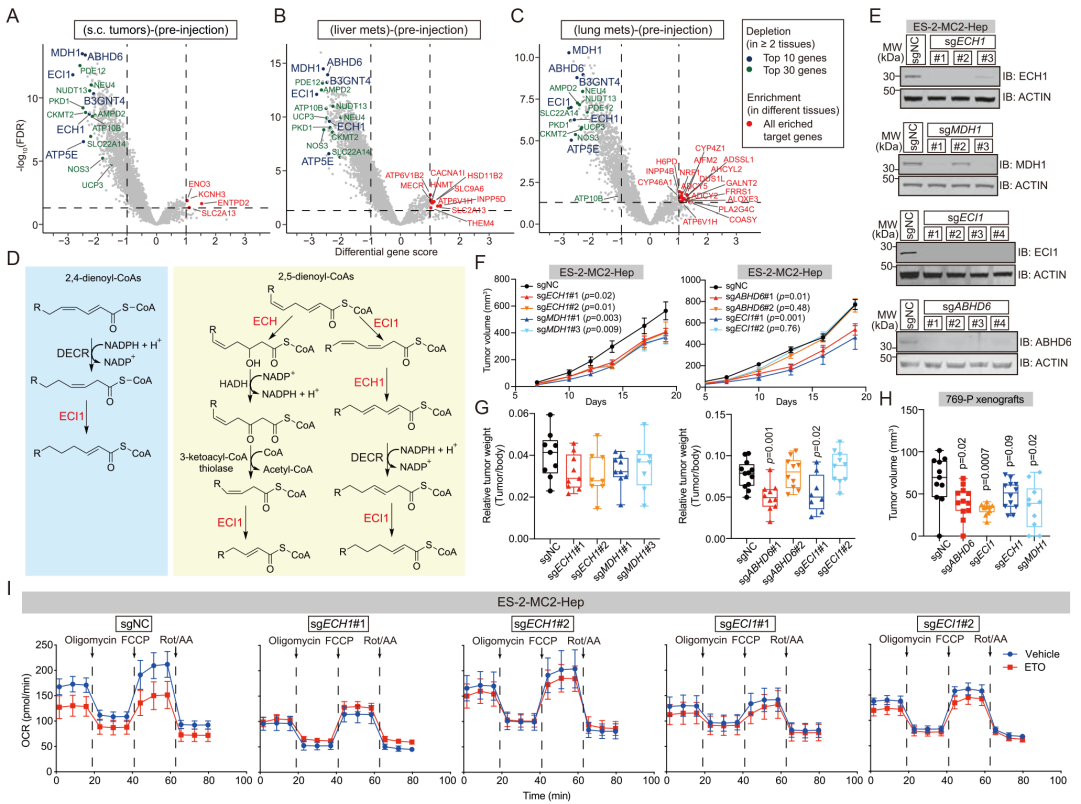
7. 富含不饱和脂质的癌细胞依靠ECI1/ECH1在体内生长
通过体内CRISPR筛选,筛选出6个在皮下肿瘤、肝转移瘤和肺转移瘤中都显著减少的sgRNA,它们靶向的基因包括MDH1、ABHD6、ECH1、ECI1、ATP5E和B3GNT4。进一步敲除ABHD6、ECI1、ECH1或MDH1可以抑制卵巢癌细胞系ES-2-MC2-Hep和肾癌细胞系769-P的皮下肿瘤生长。为了评估ECI1和ECH1这两种在UFAs(不饱和脂肪酸)预降解过程中所特有的酶是否确实是脂肪酸β氧化所必需的,进行了Seahorse分析,结果发现敲除ECI1或ECH1可以抑制ES-2-MC2-Hep细胞对ARA的呼吸利用。利用公共数据TCGA数据集发现,ABHD6、ECI1、ECH1和MDH1 mRNA的高表达水平与卵巢癌患者的预后不良相关,这表明UFA β-氧化途径的促肿瘤作用可能与人类癌症有关。
图6. 富含不饱和脂质的癌细胞依靠ECI1/ECH1在体内生长
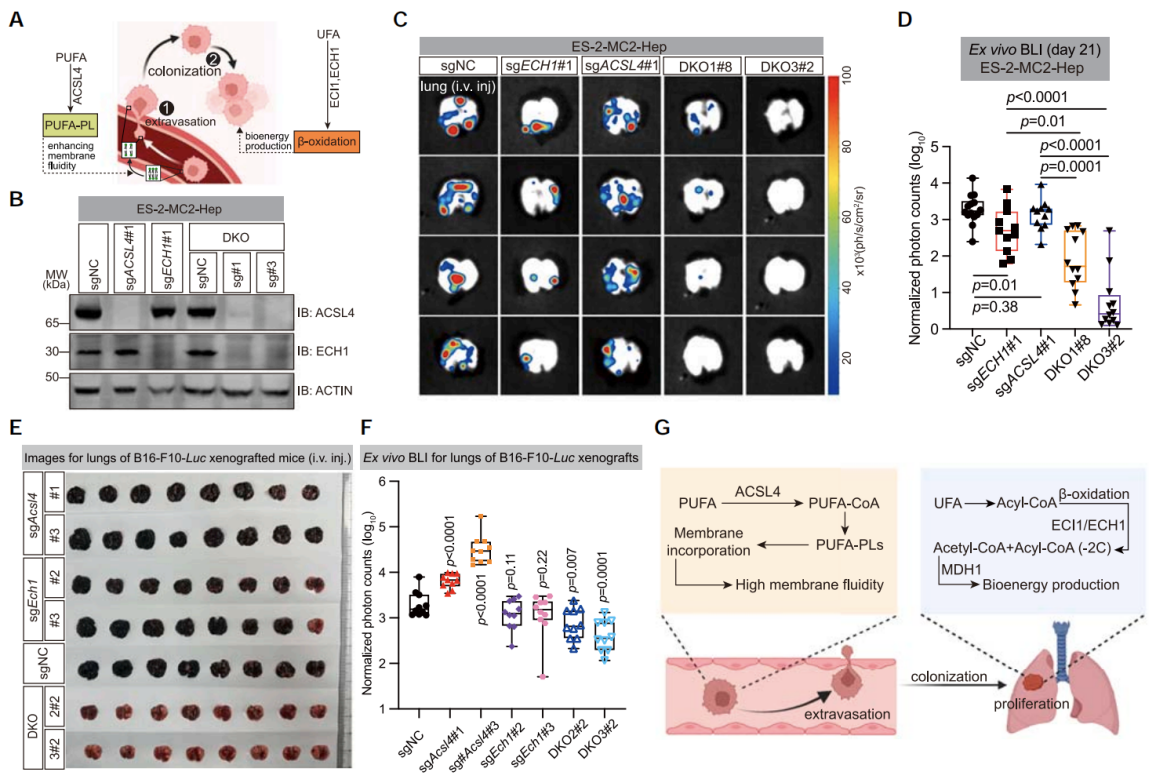
8. 双重抑制ACSL4和ECH1抑制肿瘤转移
利用CRISPR-Cas9技术敲除ACSL4和ECH1基因,构建双敲除 (DKO) ES-2-MC2-Hep细胞系,发现静脉植入DKO细胞与ACSL4或ECH1单缺失的细胞相比,在注射后21天的肺转移负荷更低。并且在敲除ACSL4的ES-2-MC2-Hep细胞中ECH1蛋白升高。在黑色素瘤细胞B16-F10细胞中,ACSL4/ECH1的DKO可以抑制肺转移,表明联合靶向UFA的酯化和β-氧化可能是治疗转移性肿瘤的有效策略。
图7. 双重抑制ACSL4和ECH1抑制肿瘤转移
小结
控制转移是癌症治疗中一个持续的挑战,本研究揭示了癌细胞转移潜力与铁死亡敏感性之间的相关性,通过在小鼠模型中进行的代谢聚焦CRISPR筛选,发现ACSL4是促进血液转移的关键因素,其通过增强膜流动性和细胞侵袭性来促进癌细胞的外渗。此外,研究还发现,富含PUFA的癌细胞在体内生长时依赖于ECI1/ECH1进行β-氧化。这些发现为未来的治疗干预提供了新的靶点,有望改善转移性癌症患者的预后。
参考文献
ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization. Cell. 2024.
请扫描二维码阅读原文
绘谱帮你测
脂代谢在各种疾病,尤其是恶性肿瘤、肥胖、糖尿病、慢性肾脏疾病、神经退行性疾病和肝病的代谢功能障碍中发挥重要作用。麦特绘谱靶向脂质组学方法已协助客户发表几十篇脂质组高分文章,涵盖各类疾病结直肠癌卵巢癌/铁死亡、NAFLD、急性肝损伤、秀丽线虫脂滴增长、秀丽线虫脂滴融合、三阴性乳腺癌/铁死亡、脂质代谢与皮肤屏障等领域,包含Science Advances, Advances Science, Theranostics, Journal of Hematology & Oncology, Journal of Biological Chemistry, cell biol toxicolL, cell mol gastroenter, Communications biology等高影响力期刊。近期麦特绘谱脂质组学系列产品三箭齐发迎来超强升级,品质更优,功能更强,可以针对客户关注的神经酰胺亚类、鞘氨醇类等,支持扩容的个性化定制需求!
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等权威期刊。