我(注:这里“我”指本期作者,而不是开放活跃创新的拓拓哈哈)一个这么保守的人,今天决定跟大家分享一个与我有相同气质的高度保守的信号通路,Wnt/β-catenin信号通路。
Wnt得名于Wingless与Int1基因,该通路是细胞间交换信息的重要手段,是胚胎及器官发育的重要信号通路之一,参与调控机体内多种细胞的增殖、分化、极化、迁移及凋亡等过程生物学过程,与肿瘤,干细胞分化,中枢神经系统疾病,心血管急性,骨科疾病等都有密切联系。
在哺乳动物中目前已经发现了19个Wnt蛋白,Wnt蛋白是棕榈酰化修饰的脂溶性蛋白,一般认为他是作为外泌体,或者跟低密度脂蛋白结合后转运到邻近的组织发挥作用。近年也有些研究认为Wnt被一个Dally样蛋白结合而水溶性增加,从而在细胞间运行。
Wnt信号通路分为经典通路和非经典通路:
经典通路:即今天要介绍的Wnt/β-actenin信号通路,最终依赖于β-actenin的核异位,大多数Wnt的蛋白都激活该通路。
非经典通路:包括Wnt/PCP通路(由Wnt11蛋白激活),以及Wnt/Ca2+通路(由蛋白Wnt5激活)。

我们从整体来看看来自KEGG的信号通路图,可以发现这条通路上有很多抑制因子。之前提到过,Wnt通路与我们的胚胎和器官发育有关,可以想象,需要对这条通路严加看管,因为它的失活或者过度表达都可能会导致灾难性的后果。
下面我们大概了解下Wnt/β-actenin信号通路:
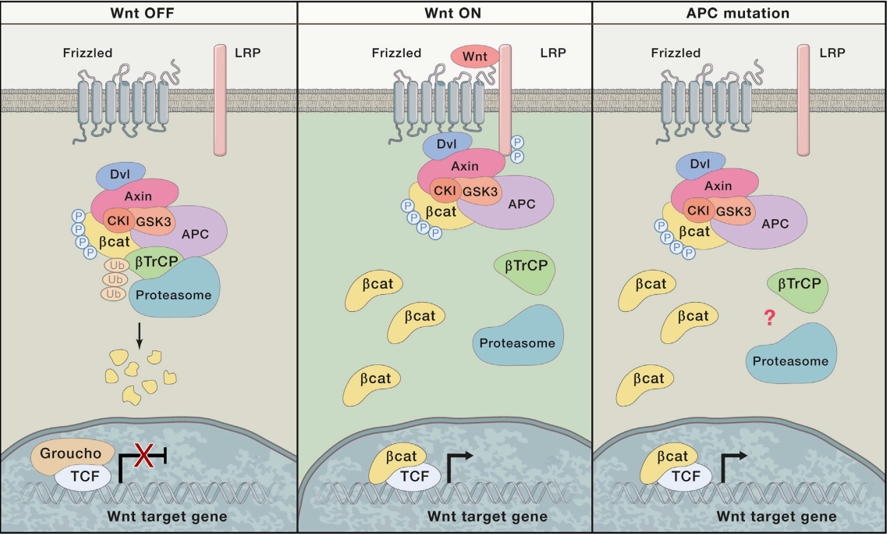
数据来源:DOI: 10.1016/j.cell.2017.05.016
在Wnt信号通路关闭的情况下,Axin、APC和GSK3β与β-catenin形成破坏复合物,β-catenin被泛素化修饰而降解。当Wnt蛋白与卷曲蛋白FZD结合后,激活Dvl蛋白,抑制 axin、GSK- 3、与 APC 蛋白,β-catenin不被降解而在胞浆内累积,并进入细胞核内,与TCF/LEF 转录因子结合,促进特定基因的转录。除此之外,APC基因突变也会导致β-catenin不被降解而积累从而核异位,APC突变在大多数结直肠癌中发生,APC-min小鼠就是对APC基因进行敲除而构建的肠道肿瘤模型小鼠。
Wnt 信号通路在心脏发育、血管生成和心脏肥大中起关键作用,在心肌损伤中,可以增加内皮细胞和心外膜细胞的增殖,促进心肌纤维化和心脏重构。下面我们通过一篇1区19.6分文章《Wnt/β catenin signaling mediates both heart and kidney injury in type 2 cardiorenal syndrome》,了解一下Wnt信号通路在心血管疾病中的研究方法。

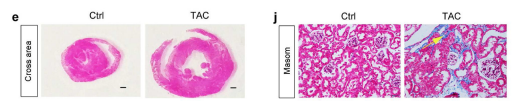
文章首先用主动脉缩窄术(TAC)构建小鼠心肌肥厚模型,通过WB检测和HE、Masson染色对模型进行评价,从结果上来看TAC引起以心脏肥大、炎症和纤维化为特征的实质性心脏病变。肾脏方面,TAC引起PC蛋白表达减少,肾组织纤维黏连蛋白升高,Masson染色显示肾间质纤维化,表明肾脏损伤。
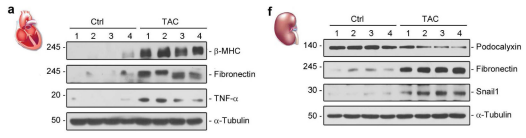
造模成功后,先用qRT-PCR检测心脏组织中19个Wnt基因,再用WB验证阳性基因中较重要的Wnt1,Wnt3a蛋白表达以及总β-catenin和活化β-catenin的表达,这里注意活化β-catenin的是非磷酸化的,选择抗体的时候有标明是Active。跟对照组相比,TAC组的上述Wnt信号通路蛋白都有表达的上调。

下一步,在TAC术后4周加入β-catenin抑制剂ICG-001和氯沙坦进行干预,观察是否对疾病的发展有影响。结果表明,加入抑制剂后,心脏肥大、炎症和纤维化指标均有改善。

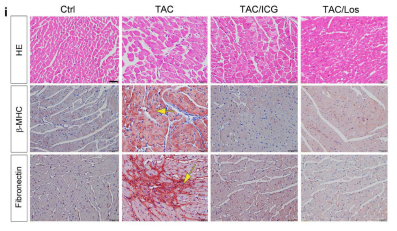
氯沙坦可有效改善TAC介导的心脏损伤,血管紧张素-肾素系统(RAS)是否可在体内调节Wnt/β-catenin信号通路?
因此作者通过体外实验和体内实验验证其假设:
体外实验中,于原代心肌细胞和心肌成纤维细胞加入Wnt 3a诱导β-catenin,RAS成分表达增加。加入β-catenin抑制剂后也抑制了RAS成分的表达。
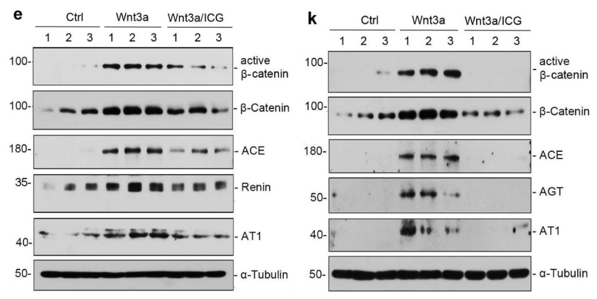
体内实验中,TAC诱导ACE、Renin和AT1在心脏中的表达;而ICG-001或氯沙坦治疗降低了这些RAS成分的表达,通过WB和病理检测结果发现,也改善了TAC诱导的肾小球损伤和纤维化反应。
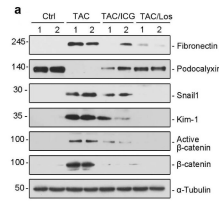

接下来,作者陷入思考,Wnt/β-catenin信号通路,RAS,心脏,肾脏,他们是通过什么机制串扰?在几种可能的途径中,血液循环是连接两个器官最可能途径。因此,作者用对照与TAC模型组小鼠的血清,处理HKC-8细胞,结果发现TAC组的小鼠血清可以活化β-catenin和增加 Snail1 and Kim-1的蛋白表达,而加入ICG-001或氯沙坦后抑制了这一作用。
为了进一步证实TAC血清激活通过β-catenin介导的肾损伤,我们用对照组与TAC模型组小鼠的血清处理β-catenin敲低的HKC-8细胞,结果显示,敲低β-catenin降低了fibronectin, Kim-1, Snail1以及RAS蛋白成分的表达。


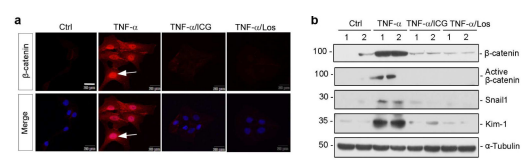
作者通过对小鼠血清的检测,选定炎症因子TNF-α进行验证。通过免疫荧光对β-catenin进行染色,发现TNF-α引起β-catenin在HKC-8细胞核内积聚,而TNF-α处理细胞的同时加入ICG-001或氯沙坦,β-catenin的核内积聚被阻断。通过WB分析,TNF-α同样上调了Snail1和 Kim-1的表达,且ICG-001或氯沙坦抑制TNF-α的这一作用。以上数据表明,TAC模型血清TNF-α含量升高,TNF-α引起Wnt/β-catenin信号通路的激活,并引起肾脏细胞的损伤。
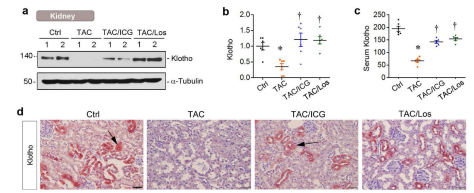
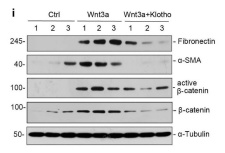
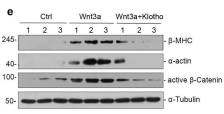
接下来,作者又发现,肾脏一个抗衰老蛋白klotho,在TAC模型小鼠的血清或肾脏中表达被抑制,而TAC模型的ICG-001或氯沙坦治疗组,Klotho恢复了其表达。最后为了探寻可能的机制,通过上述提到过的类似方法,在原代心肌细胞和心肌成纤维细胞进行体外实验,表明Klotho蛋白的缺失会增强Wnt/β-catenin信号通路的表达,增加了心肌细胞的肥大和纤维化程度。
到此,故事讲完了。
我的体会是,现在对于疾病及其相关机制的研究,不仅仅满足于某一脏器,某一机制,更多的是疾病的脏器间是否有串扰,机制方面也可以研究不同通路的联合,如Wnt/β-catenin和Hippo/YAP,Wnt/β-catenin和Notch,在很多方面都相互影响,又或者某信号通路与研究热点进行联合分析,如Wnt信号通路与m6A甲基化修饰,Wnt信号通路和铁死亡等。
