文章题目:液态活检技术对大样本肿瘤进行回顾性研究,揭示ctDNA突变规律
Genomic alterations in circulating tumor DNA from diverse cancer patients identified by next-generation sequencing
研究单位:加州大学圣迭戈分校穆尔斯癌症中心等
发表时间:2017年8月
期刊名称:Clinical Cancer Research
影响因子:9.61
分区:医学1区(Top期刊),肿瘤学1区,综合生物学1区
利用二代测序技术检测血液中的携带肿瘤突变信息的ctDNA是一种理想的非侵入性检测方式,但是针对大规模数量的病人进行ctDNA检测目前类似的研究依旧数量不多。来自加州大学圣迭戈分校的Razelle Kurzrock团队搜集了670份不同肿瘤病人的血浆样本,利用二代测序的gene panel对血浆样本中的ctDNA进行检测。
肿瘤病灶部位主要包括肠胃(31.8%)、脑部(22.7%)、肺部(20.7%)等。超过63%病人的ctDNA至少携带一种突变。其中最常见的突变基因有TP53、EGFR、KRAS、PIK3CA等。脑癌患者中超过32%的病人,其ctDNA携带至少一种突变以上。多变量分析显示头颈癌患者携带有大量的突变信息。在这670名病人中,有320名病人(48%)的驱动基因上携带有突变信息,这当中又有241名病人有对应的靶向药物。部分临床试验已经证实靶向药物治疗能够针对部分病人有着良好的疗效。这项研究证实了液态活检技术在精准医疗上的应用具有广泛的应用前景,包括二代测序检测ctDNA结合影像学对病人用药前后进行检测等。
前言介绍
肿瘤中携带的多种基因突变都是潜在的药物靶点。液态活检技术的兴起为ctDNA检测提供了极大的技术支持,其中利用二代测序平台检测ctDNA中的用药靶点会逐渐成为未来的趋势。传统的侵入式检测如组织穿刺会给病人带来极大的痛苦,检测成本和准确度也一直存在极大的争议。部分病人在接受组织穿刺后,仍不能有效检测出突变信息。据统计,约30%的非小细胞肺癌病人(NSCLC)难以通过组织穿刺的方式获取突变信息,采用石蜡包埋的方式容易引起胞嘧啶(C)向胸腺嘧啶(T)改变,这会对后期分析带来极大的不便。
肿瘤系统并非一成不变而是动态的。靶向药等外界因素在降低靶向位点突变频率的同时,一些新的突变随之而来。据调查,约50%的NSCLC病人在接受EGFR激酶抑制剂如厄洛替尼、盐酸埃克替尼、阿法替尼等药物治疗后,T790M的突变率显著上升。
ctDNA(circulating tumor DNA)即循环肿瘤DNA是人体血液循环系统中不断流动的携带一定特征(包括突变,缺少,插入,重排,拷贝数异常,甲基化等)来自肿瘤基因的DN**段。一般来源于坏死或凋亡的肿瘤细胞、循环肿瘤细胞和肿瘤细胞分泌的外排体。通常晚期肿瘤病人的血液中含有更高浓度的ctDNA。利用液相捕获技术和多重PCR技术捕获血浆中的ctDNA,再配合超高深度的二代测序技术,使得ctDNA检测的灵敏度有了质的飞跃,并且和组织样本检测结果高度一致。ctDNA检测逐渐成为病情监测和用药靶点有效手段之一,其便捷性和非入侵性等特点使得液态活检技术在这几年大放异彩,2015年更是被MIT Technology Review评选为十大突破技术。
材料与方法
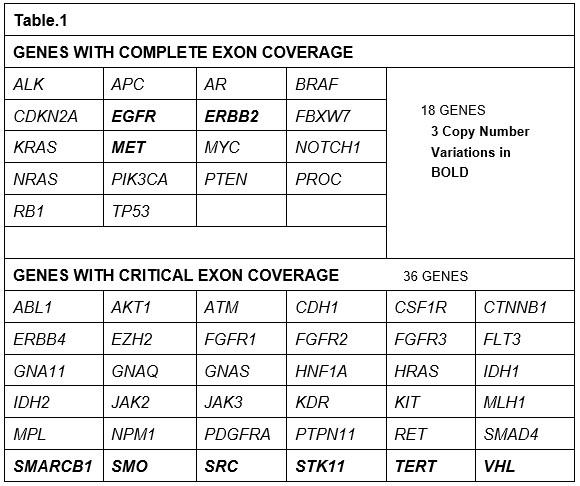
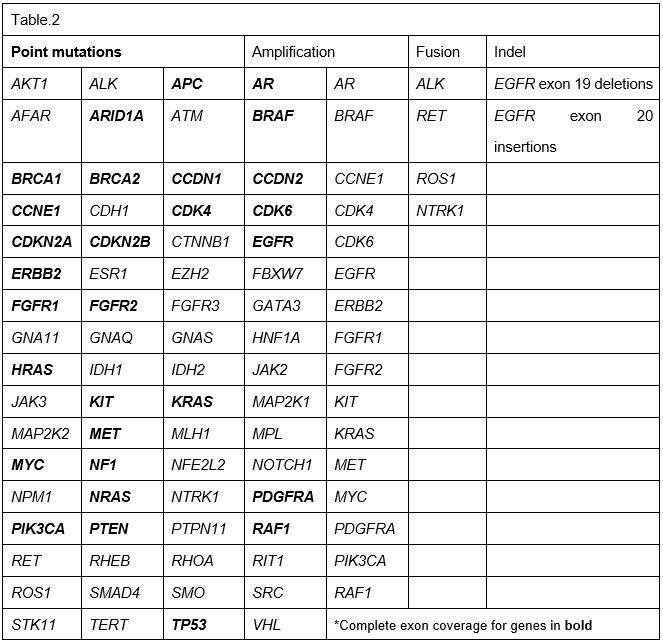
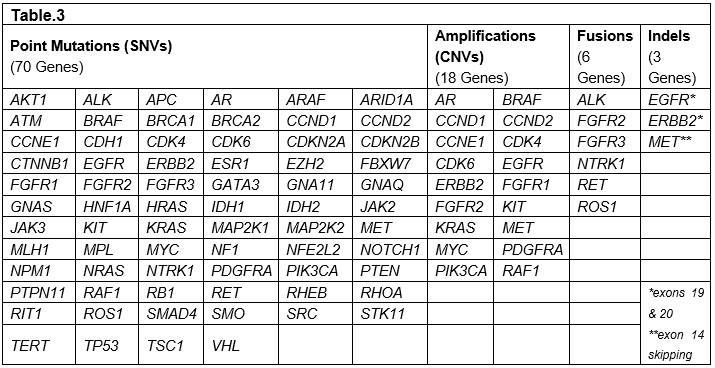
利用液态活检技术进行大样本的回顾性研究,对670名患有不同肿瘤的病人血浆,在用药前和用药后进行连续性的ctDNA检测。这些病人通常已发生病情恶化或发生肿瘤细胞转移。其中150名病人使用的是54 gene panel进行检测(Table.1),400名病人使用的是68 gene panel进行检测(Table.2),120名病人使用的是70 gene panel进行检测,后期还增加18个基因扩增与6个基因融合检测(Table.3)。胚系突变(germline mutations)在本次研究中暂不报道。后期结合影像学会对部分病人用药前后进行监测。
结果
1.患者特征
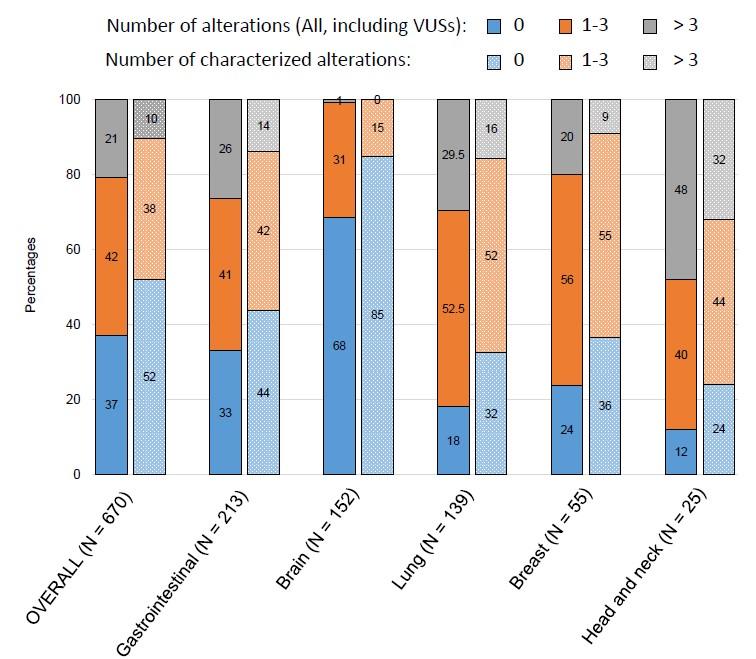
670名病人患有不同类型的肿瘤,平均年龄62岁(5-92岁),男性患者和女性患者比例大致持平。比例最高的病灶部位分别是肠胃(31.8%),脑部(22.7%)和肺部(20.7%)。
2.ctDNA检测结果
周转时间即从血样采集到分析结果的中位数时间为15天左右(7-35天之间)。在所有的670名病人中,63.1%的病人携带有至少有一种突变。高频突变包括TP53(32.5%),EGFR(13%),KRAS(12.5%),PIK3CA(9.1%)以及APC(6.6%)。
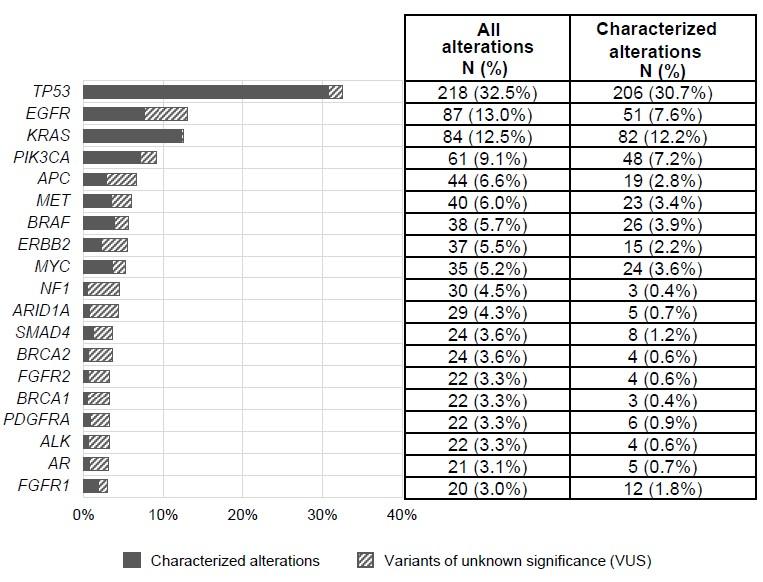
这670名病人中所有的突变(N=1387)里,ctDNA被检测出的百分比中位数是0.98%。
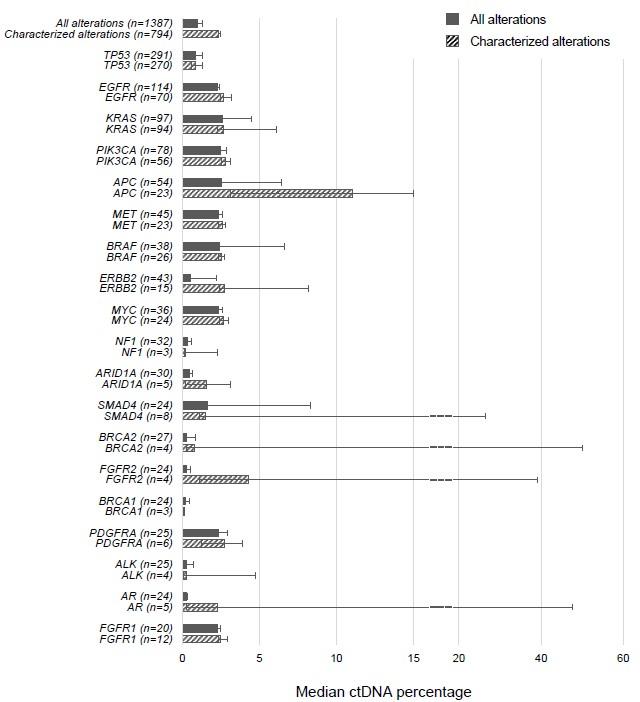
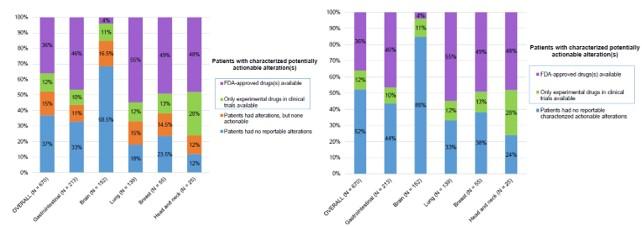
其中32%的脑癌病人(N=49/152)至少携带有一种突变,超过88%的头颈癌患者检测到多种突变信息,包括TP53、BRCA2、PIK3CA等。
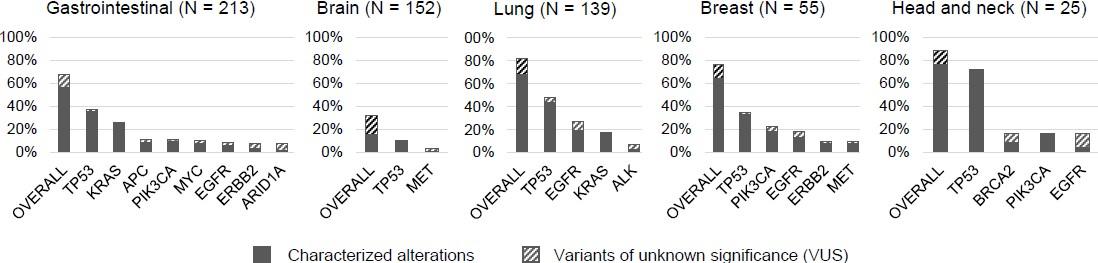
多变量分析显示,肿瘤病人的临床特征与被检测出的突变数相关。头颈癌会出现多种突变类型,而脑部肿瘤携带的突变肿瘤更少。此外,无论是TP53、EGFR、KRAS或PIK3CA等突变在ctDNA的检测中至少有一种在血浆中的突变频率超过10%。
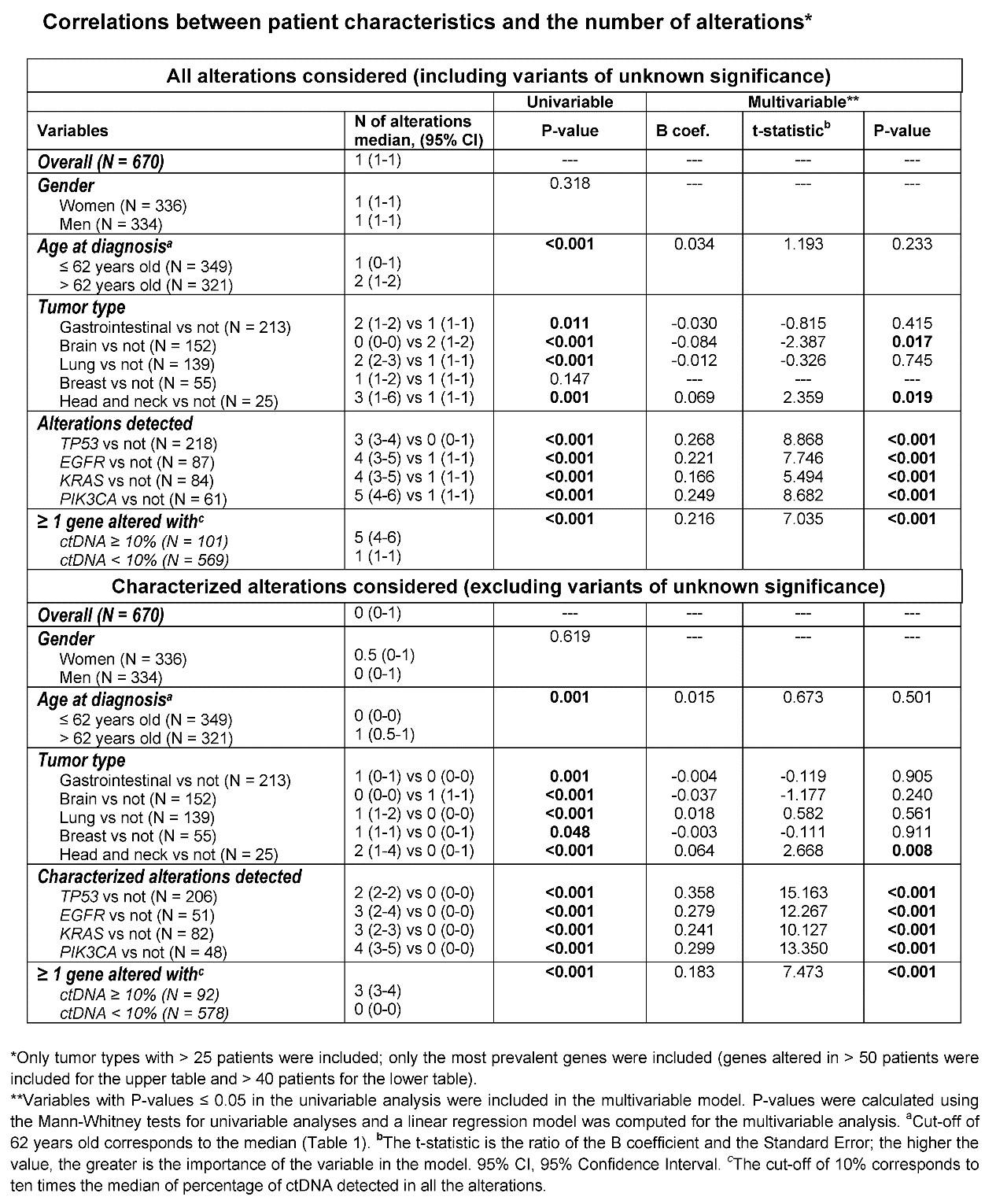
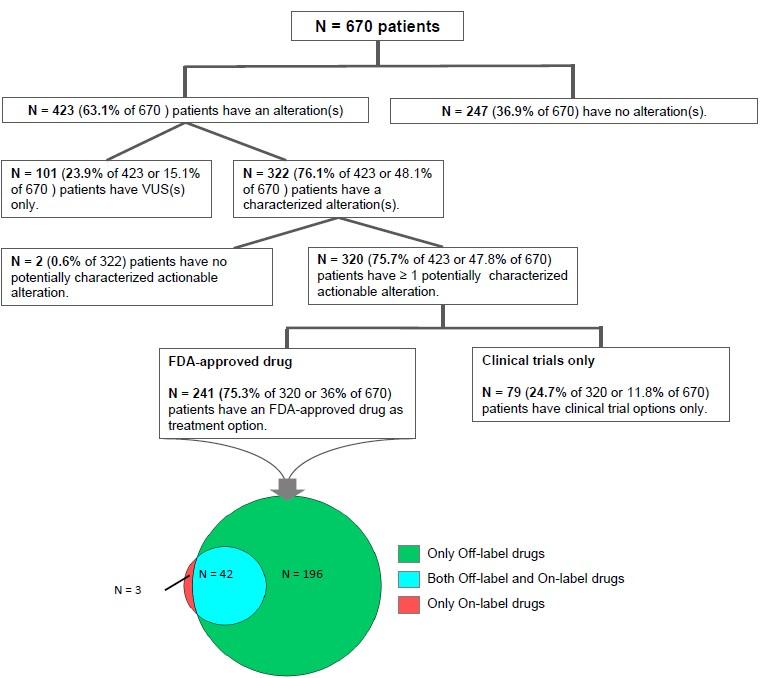
在670名肿瘤病人中,320名病人携带的突变位点有对应的靶向药物。这其中又有241名病人至少有一种以上的靶向药物可供选择(45名病人的可用药物已被FDA批准上市,196名病人的可用药物为未上市的靶向药)。这些病人主要包括肠胃癌、肺癌、乳腺癌和头颈癌。另外的350名病人没有检测出用药靶点突变信息,247名病人的血浆中未检测出任何ctDNA携带有突变,101名病人携带有未知突变。
3.案例
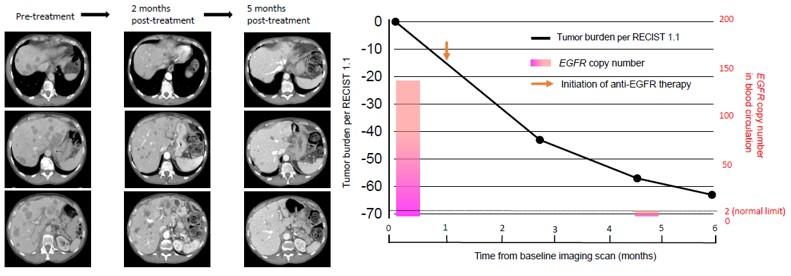
案例1:携带有EGFR扩增的肺癌病人使用靶向药治疗前后的ctDNA监测
68岁女性胃癌患者已发生肝脏转移,组织检测以及血浆ctDNA检测同时发现EGFR扩增现象。使用厄洛替尼和西妥昔单抗治疗一周后,病情出现缓解。靶向药连续治疗2个月和5个月后,结合CT影像学检查发现肝脏转移现象得到显著缓解,ctDNA检测也显示EGFR在血浆中的拷贝数显著降低。
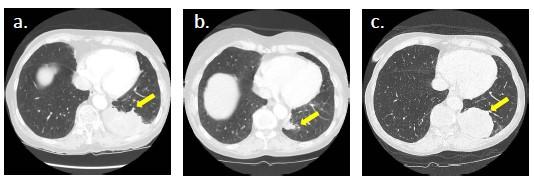
案例2:携带有EGFR突变的肺腺癌患者在使用厄洛替尼前后的ctDNA监测
77岁女性肺腺癌患者已发现出现脑转移和骨转移。ctDNA检测结果表明该患者携带有EGFR19号外显子缺失(E746_A750 del)。组织样本使用gene panel检测发现,除了有EGFR E746_A750 del外,还发现了EGFR扩增、AURKA扩增、GNAS扩增、ZNF217扩增以及TP53 c.375+1G>T。患者一开始使用厄洛替尼治疗并同时接受脑部放疗。使用厄洛替尼治疗一周后,脑成像结果显示脑转移现象得到显著缓解,于是停止放疗。胸部CT检查显示对药物有部分应答。经过厄洛替尼治疗8个月后,影像学检查发现病情出现恶化。ctDNA检测结果表明患者并未发现T790M突变,但仍存在EGFR E746_A750 del和EGFR扩增。于是启动化疗方案。
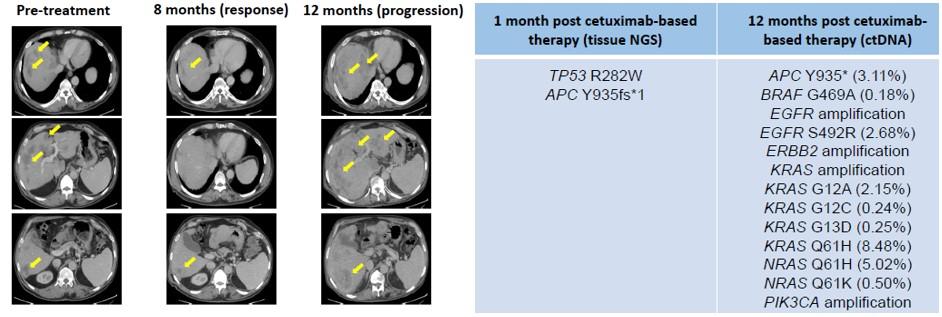
案例3:KRAS野生型结直肠癌患者使用西妥昔单抗前后的ctDNA监测
55岁男性结直肠癌患者,在接受联合化疗方案(奥沙利铂+伊立替康+贝伐单抗)后病情恶化,出现肝脏转移。随后启动三线治疗方案(西妥昔单抗+5FU+伊立替康)。一个月后,肝脏组织检测发现TP53 R282W和APC Y935fs*1突变。起初病人对以西妥昔单抗为主的三线治疗方案有部分应答,但是一年后病情出现恶化。ctDNA检测发现许多新型突变,包括EGFR、HER2、KRAS和PIK3CA扩增,以及EGFR S492R、BRAF G469A、KRAS G12A/G12C/G13D/Q61H和NRAS Q61H突变。
结论
ctDNA是循环肿瘤DNA(circulating tumor DNA),是原发肿瘤甚至是转移形成的新肿瘤上的细胞破裂掉落下来的DN**段,也是进入了外周血循环系统。它甚至比CTCs(circulating tumor cells)更具价值,因为在肿瘤形成早期血液中往往还没有CTCs但是却已经开始有ctDNA了,这意味着可以通过检测ctDNA而发现早期的肿瘤。这对于肿瘤早筛、用药和预后都是非常有意义的。当然技术上也更难。
使用ctDNA检测能够对病情进行持续监控,而组织穿刺除了存在费用高、痛苦大、结果不准确等问题还不能对病情进行持续监控。
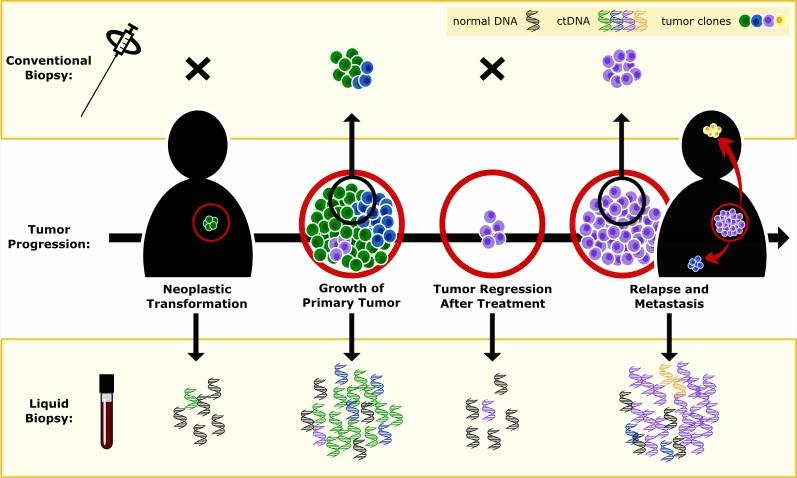
近几年,关于大样本规模病人的ctDNA检测研究逐渐增多,配合以影像学能够针对病人在用药前后和手术前后进行持续监测。样本大能够从宏观层面,准确挖掘肿瘤进化、反应化疗耐药及早期发现肿瘤复发等信息。
当然本次研究仍存在诸多的不足,如已知数据库注释偏少、临床数据不足等问题。此外与组织检测相比,疾病分期和治疗结果仍然不甚理想。利用二代测序技术,对血浆中的ctDNA进行检测,其精确度和灵敏度还有很大的提升空间。
文章解读完毕
回复“液态活检+邮箱”即可获取原文
如需讨论,请留言给小编~
我们的技术专家会给您专业的答复哦~
相关阅读:
Journal of Proteomics | 联合蛋白质组学和转录组学技术鉴定白色霞水母刺蜇相关的毒素
