1.研究背景
自我更新和多能性是胚胎干细胞(ESC)的两个基本特征,这两个特征是受多种调节因子调控的,包括多能因子、表观遗传调节因子和miRNA等。组蛋白甲基转移酶是一类非常关键的表观遗传调节因子,但组蛋白甲基转移酶如何与miRNA及核心多能因子系统形成一个调控网络来调节ESC干性仍然是个未知数。
2.研究目标
本研究中休斯敦德克萨斯大学生物医学研究所及德克萨斯大学MD安德森癌症中心的Min Gyu Lee研究团队利用microRNA微流体芯片技术对小鼠胚胎干细胞(mESC)进行了研究,以期了解组蛋白甲基转移酶7(PRMT7)如何与miRNA及多能因子形成新型表观遗传干细胞调控机制。
取材:
PRMT7耗尽组和对照组小鼠ESC
3.研究结果
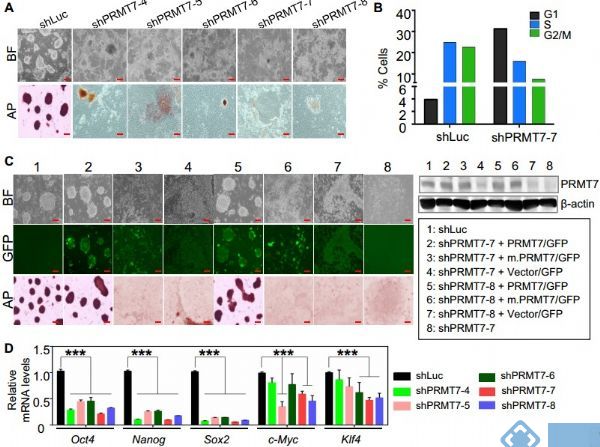
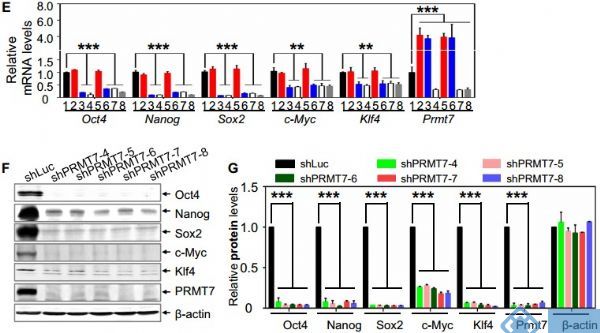
本研究显示蛋白质精氨酸甲基转移酶7(PRMT7)是小鼠胚胎干细胞维持干性必需的多能因子。PRMT7通过上调对称二甲基化H4R3的水平来抑制miR-24-2基因编码miR-24-3p和miR-24-2-5p。值得注意的是,miR-24-3p靶向主要多能因子Oct4、Nanog、Klf4和c-Myc的3'非翻译区(UTR),而miR-24-2-5p则沉默Klf4和c-Myc表达。miR-24-3p和miR-24-2-5p也靶向其阻遏物基因Prmt7的3'UTR。miR-24-3p和miR-24-2-5p诱导小鼠ESC分化,其反义抑制剂大大逆转了PRMT7耗尽小鼠胚胎干细胞的自发分化。Oct4、Nanog、Klf4和c-Myc正调控Prmt7的表达。
图 PRMT7及其催化活性对mESCs干性是不可或缺的;PRMT7耗尽的mESCs中Oct4,Nanog,Klf4和c-Myc蛋白水平比其mRNA水平更低
4.研究结论
这些发现将miR-24-3p和miR-24-2-5p定义为一种新的抗多能性miRNA,并且还揭示了一种新型表观遗传干细胞调控机制,其中由PRMT7和miR-24-3p / miR24-2-5p与Oct4、Nanog、Klf4和c-Myc相互作用组成的一个双重负反馈环路可以调控ESC干性。
5.参考文献
Sung-Hun Lee, et al. (2016) A feedback loop comprising PRMT7 and miR-24-2 interplays with Oct4, Nanog, Klf4 and c-Myc to regulate stemness. Nucleic Acids Research. doi: 10.1093/nar/gkw788.
本研究中的microRNA微流体芯片由联川生物提供
需要文章的小伙伴,欢迎回复文章题目至公众号,并留下您的邮箱,向小编免费索要哦~
扩展阅读:
Plant Journal:番茄lncRNA16397与致病疫霉抗性产生机制研究
MiR-181a在调节人瘢痕瘤成纤维细胞的增殖和凋亡中的作用、