干细胞培养常用因子TGF-β,肿瘤免疫潜力靶点
一、TGF-β家族发现
1985年,Sporn实验室首次克隆了TGF-β的cDNA,并在大肠杆菌中成功表达。TGF-β是一类由TGF-βs、骨发生蛋白(Bone morphogenetic proteins,BMPs)、活化素(Activins)、抑制素(Inhibins)组成的超家族多肽类生长因子,负责细胞发育、生长、分化、迁移和凋亡,参与维持人体内稳态及各种疾病进展。在哺乳动物中至少发现有TGF-β1、TGF-β2、TGF-β3、TGF-β1β2四个亚型,它们通过相同的受体信号通路发挥功能。
TGF-β是由两个结构相同或相近的、分子量的12.5kDa亚单位借二硫键连接的双体。单体的TGF-β是由含400个氨基酸残基的前体份子(pre-pro-TGF-β)从羧基端裂解而来。Pre-pro-TGF-β N端含有一个信号肽,在分泌前被裂解掉,成为非活性状态的多肽链前体(pro-TGF-β),通过改变离子强度、酸化或蛋白酶水解切除N端部分氨基酸残基,所剩余的羧基端部分形成有活性的TGF-β
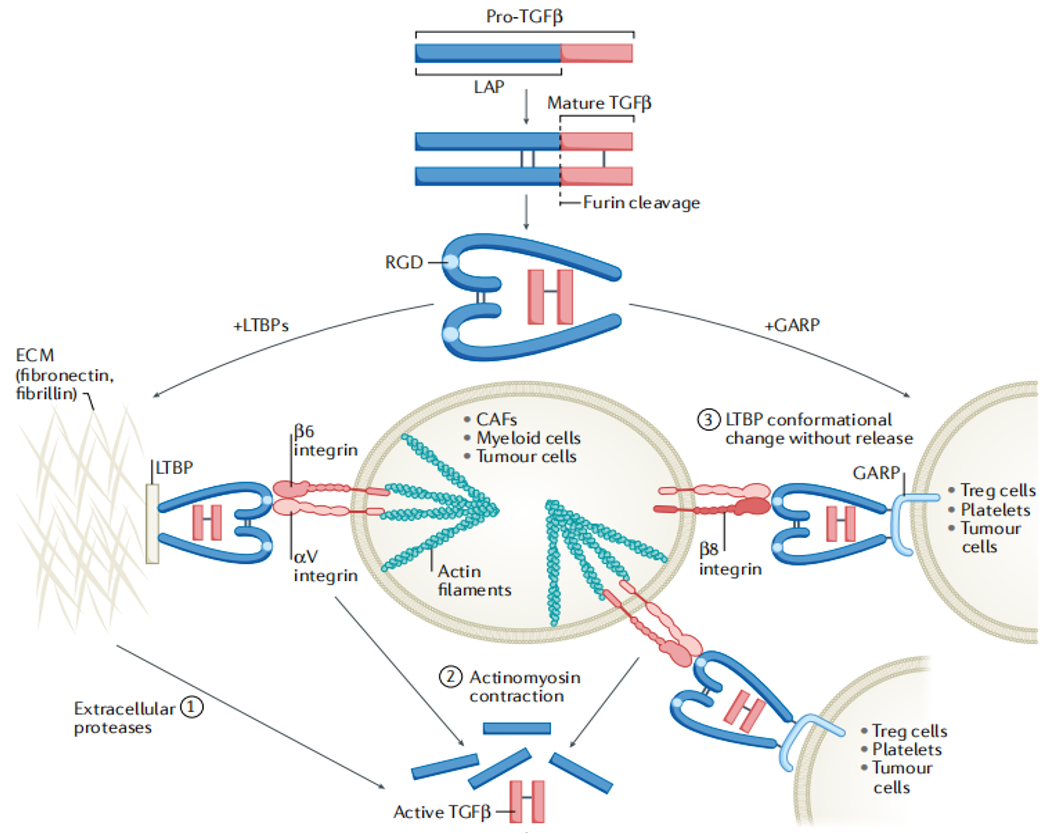
图1. TGF-β合成与分泌[1]
二、TGF-β信号通路
TGF-β信号通路包括经典/Smad依赖信号途径和非经典/Smad独立途径。
1.经典/Smad依赖信号途径
有活性的TGF-β首先与细胞膜上的TGF-β RII受体结合并使之磷酸化,结合成多聚体而活化;活化的TGF-β RII在细胞内磷酸化Smad2/3,组成p-Smad2/3,并与受体分离;分离后的p-Smad2/3与Smad4结合,形成复合物进入细胞核内,在核内调控靶基因的转录,产生生物学效应。
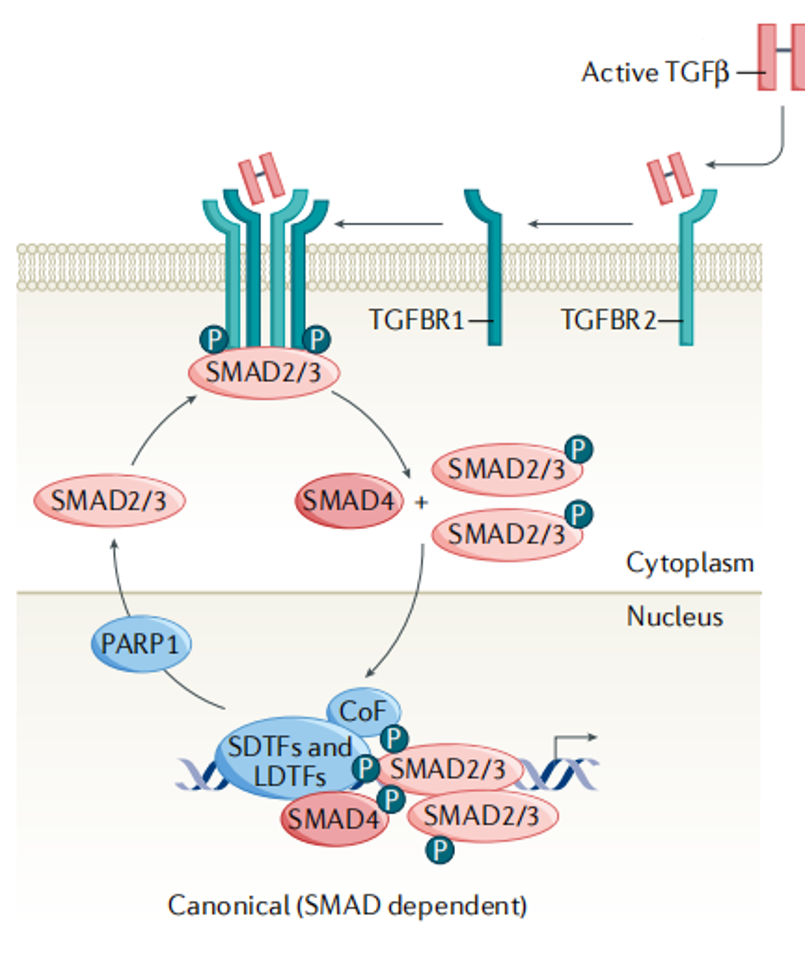
图2 . TGF-β经典/Smad依赖信号途径[1]
2. 非经典/Smad独立途径
细胞中TGF-β信号传导的多样性不仅取决于各种配体受体介质或Smad相互作用蛋白,还取决于TGF-β激活其他信号通路的能力。
在非经典途径中,TGF-β受体复合物通过其他因子传递信号,如RHO、PI3K-AKT、ERK、JNK、NF-kB,间接参与细胞凋亡、上皮-间充质转化、迁移、增殖、分化和基质形成等。

图3. TGF-β非经典/Smad独立途径[1]
三、TGF-β与肿瘤
TGF‐β具有抑癌和促癌的双重作用。它通过激活Smad4抑制4e-BP1(真核翻译起始因子-4F(EIF4E)启动子)的活性,从而抑制细胞的生长和增殖,可诱导癌前细胞凋亡,抑制癌细胞增殖。此外,TGF‐β也可通过下调原癌基因(Myc)的表达,从而抑制细胞增殖。
然而,TGF‐β在多种机制的参与下,从抑癌因子“叛变”为促癌因子。在肿瘤进展过程中,肿瘤微环境中肿瘤细胞、间充质成纤维细胞和其他细胞大量分泌TGF‐β。一方面,肿瘤细胞通过分泌大量TGF‐β使自身处于高浓度TGF‐β环境下,从而建立耐受性。另一方面,TGF‐β抑制免疫细胞的抗肿瘤活性从而促使肿瘤细胞逃避免疫系统的监视,进一步促进肿瘤的进程,此时的TGF‐β反而促进肿瘤细胞发生TMT,促进其浸润和转移。
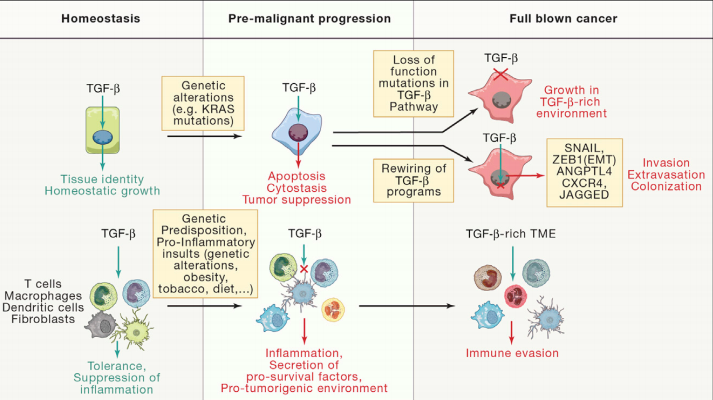
图4. TGF-β的抑癌与促癌作用[2]
四、TGF-β与干细胞
TGF-β经细胞分泌后主要以非活性状态储存于细胞外基质中,相较于其他众多生长因子具有自身鲜明的特点。TGF-β信号通路在调控干细胞自我更新与分化和器官形成中同样发挥着重要的作用,当TGF-β信号通路各成员活性未激活时,体内会自发性发生多种癌症,这表明TGF-β定向调节干细胞对癌症形成也具有不可或缺的功能。TGF-β信号通路下游的跨膜TGF-β受体是多个SMAD蛋白,这些蛋白是TGF-β超家族信号传递的重要调控分子,并在不同层面上受多种多样精确的调控。在干细胞培养中,TGF-β1常与bFGF一起用于未分化的人类胚胎干 (ES) 细胞和诱导多能干 (iPS) 细胞的培养。
五、TGF-β相关产品信息
|
产品名称 |
货号 |
|
91701ES08 |
|
|
91703ES08 |
|
|
91705ES08 |
|
翌圣生物科技(上海)股份有限公司 商家主页地 址: 上海市浦东新区天雄路166弄一号楼三层南单元 联系人: 李自转 电 话: 400-6111-883、021-34615995-8075 传 真: 021-34615995-188 Email:lizizhuan@yeasen.com 相关咨询邀请函 | 翌圣生物亮相美国 AMP 2025!聚焦分子诊断前沿,共探精准医学未来 (2025-11-12T00:00 浏览数:13103) 第七届“最美曲线”即将开启!快来赢取千元好礼 (2025-11-05T00:00 浏览数:16974) 翌圣生物精彩亮相 ICG-20,共绘行业未来! (2025-11-05T00:00 浏览数:15303) 邀请函 | 就在明天!翌圣生物邀您共赴ICG-20! (2025-10-23T00:00 浏览数:28486) 邀请函 | 扬帆海外!翌圣生物亮相美国人类遗传学年会(ASHG 2025) (2025-10-14T00:00 浏览数:33136) 喜讯!翌圣生物作为主要起草单位,参与团体标准制定 (2025-09-24T00:00 浏览数:34558) 热烈祝贺!恩瑞恺诺Ⅰ类新药KN5501细胞注射液IND成功获批 (2025-09-12T00:00 浏览数:43789) 热烈祝贺!成都优赛诺脐血来源异体通用型CAR-T获中/美双 IND批准 (2025-09-12T00:00 浏览数:43373) 直播预告 | 满满干货!NGS生信分析免费直播课(第四期)预约中 (2025-09-12T00:00 浏览数:36886) @所有人!您有一封翌圣CSGCT 2025的邀请函待接收! (2025-09-08T00:00 浏览数:40665) ADVERTISEMENT
|
