摘要
近年来对于医疗器械的安全性和有效性要求愈发提高,而其中由于用户界面设计缺陷导致的使用问题也逐渐凸显。各国相继出台了法规和标准要求医疗器械生产厂商开展可用性工程,确保设计出来的用户界面满足用户需求,保障器械的安全有效使用。在这样的背景下,诺达思通过测试场景搭建,测试工具支持,测试服务支持的三大手段,帮助大量医疗器械生产厂家从0到1量身定制了自己的可用性工程流程,为客户在质量管理,产品注册,满意度提升等多方面做好了助推作用,为医疗器械行业做出让用户用起来更安全,更满意的产品提供了支持与辅助,取得了显著的社会与经济效益。
关键词 医疗器械可用性 医疗器械人因工程 风险管理
作者 杨朋翰 宁宁
背景
设想一下这样一个场景,一个81岁的女性患者,由于乳腺癌在医院进行治疗,电解质检测发现血钾有点低,医生开具医嘱进行50mL氯化钾微量注射泵入,10小时泵完。当天值班的护士顺手就拿了一个100mL的注射器,按照她通常操作微量注射泵的方式完成了操作,整个过程注射泵界面上没有任何异常显示,由于界面是英文,护士也养成了忽略界面反馈的其他信息的习惯,最终护士在预充排气后确认了设置的参数是5mL/h的注射速度。但当晚巡视的时候,护士却发现注射泵6小时就完成了药物泵入,比预定速度快了近一倍,赶紧通知了医生采取补救措施。

注射泵人机界面
上面的这个案例是发生在一个三甲医院的真实事件,分析后发现,该注射泵能识别的最大注射器为60mL的注射器,当护士将一个100mL注射器放入注射泵时,注射泵错误的将之识别成了60mL,并在界面上给出显示,但由于平时操作中,护士已经习惯忽略英文界面的文字反馈,只关注最后的注射速率这个参数,最终使得注射泵速率计算的时候出错。
![]()
厂家仅在说明书当汇总做了相关说明
到这里大家可以把自己想象成一个管理者,来回答下面两个问题,面对这样一起不良事件:
1.到底是护士的过失还是厂家防呆设计不到位?
2.之后怎样才能有效避免这一类的错误?
这两个问题其实是高度相关的,如果我们认为是护士的过失,那之后的应对手段就是加强对护士操作设备的培训,加强对护士的管理,增加使用器械的时候的确认环节。
如果认为是器械的问题,会要求厂商做防呆设计,确保不合规格的注射泵无法放入,或者在设备上增加相关警示标识,在界面增加报警。
对比这两种处理手段,我想大家都能感受到,一劳永逸的办法来自后者,即对设备固有安全性的调整。
早在上世纪末,美国FDA就这类问题做过讨论,争论到底是使用者错误还是使用错误,后来通过多项专业的研究调查,在1996年的时候其下属的CDRH评估使用错误相关的报告,包括召回,现场改正。发现了大量不良事件是由于用户界面设计缺陷造成的问题,并发现,通过改进界面设计能解决问题,由此确定了用户界面的设计缺陷也是产品的质量问题,并保护了医务人员,避免他们为不好的设计买单。
2019年通用电气的一款婴儿培养箱出了几次医生忘记锁上操作窗,发生的婴儿跌落事件,这样一个事情既可以说是医务人员操作不当,没及时锁定导致,也可以说是产品设计,没能很好传达给用户明确的锁定反馈导致的。最终我们看到的是GE的产品被召回,这也说明业内达成了共识,用户界面在设计的时候就应该尽可能的去解决这样的潜在风险。

GE婴儿培养箱由于操作窗锁定装置反馈不明确被召回
但在我国的医疗不良事件中,如果不是设备本身质量问题导致的,都归属卫健委管理,而很少有人认识到,不好的用户界面设计也是属于质量问题,这就导致我们对医务工作人员的个人技能,个人素养要求过于苛刻,有一些反直觉的设计,我们却要要求医务人员去习惯。
在美国,每年约有98000人死于医院,英国有11859人死于医疗过失,其中许多是由于人类操作者使用医疗器械不当造成的。这些过失通常是由操作错误(缺乏知识或培训,界面设计有缺陷)或缺乏技能(在自动化程序中)引发的。有趣的是,尽管获得技术的途径有所改善,医疗创新蓬勃发展,但英国医疗器械不良事件报告数量却有所增加。
我们经常会在可用性测试结果汇报时,听到来自设计师、项目经理的反馈,“他(用户)出现这样的‘低级错误’,我们有什么办法?”,但结果往往相反,比如文章开头的不良事件,即便护士出现了这样的“低级错误”,厂商依然可以使用防呆设计,警报提示等方式进行应对。
有的生产厂家可能也要开始辩解了,这些不良事件中的很多都是我们设计的时候想象不到的,操作我们设备的人,形形色色,我们不可能保证每个用户都能完全按照我们的设计去使用产品,也没办法预判用户都会做出哪些违背常理的操作,这样的要求对厂家来讲是不是也有点太高。
虽然使用相关的错误在识别上确实很有难度,但人因工程的发展早就给识别这类错误提供了方法。
首先有一些使用错误我们通过风险分析的方式,桌面研究,或者PCA分析,任务分析就能简单的识别出来,比如下图的两种药品在包装上非常相近,那很容易想象到药剂师会由于心不在焉给错药,这样我们就能改变包装设计,提前预防。
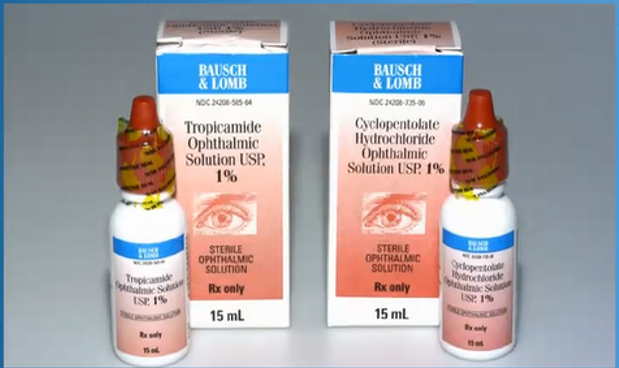
左侧:Tropicamide 托吡卡胺:12-15岁青少年眼光扩瞳
右侧:Cyclopentolate 环喷托酯:3-12岁儿童眼光扩瞳
然而另外一些潜在的使用风险,比如警报当中的文案,电源线路的连接,紧急情况下界面的操作方式很难通过桌面的分析发现其中的使用相关的风险,因此人因工程在这里就要引入我们真实的用户,在接近真实的场景下,完成真实的使用过程(特别是那些风险很高的使用过程,比如处理报警信息,在紧迫的事件内完成某一个操作等),进而观察用户在模拟的使用场景中是否会出现错误操作,以及潜在风险。简单一句话就是,将人当作检测工具,来检测用户界面的可用性。
法规要求
随着业界对可用性工程越来越重视,各个国家也相继出台了法规和标准,要求各大厂商考虑用户界面的可用性以及与之相关的风险,甚至明确要求厂商要了解用户的需求。
法律制定者为什么也会关注医疗器械的可用性呢?
正如前文所诉,有大量的研究报告指出,很多可避免的医疗事故,是能够通过在产品设计中增加可用性的流程来加以应对的,FDA在2000年的时候就发布了人因工程指南文件,因此已经有明确的方法指导厂家开展工作,应对使用错误。
要求厂商仅仅了解自己的设备和界面是不足以保证医疗器械被安全有效地使用的。影响使用结果的因素还包括了使用这个器械的用户,是谁?有什么样的背景?有什么样的经验?身体能力如何?在什么样的环境下,使用该设备。
因此不管是哪个国家的法规,总的来说都会从如下五点要求厂商做好设备的可用性:
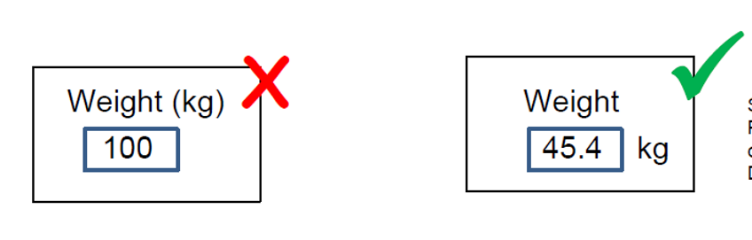
1. 厂商需要开展调查,了解真实的用户,了解使用环境。这就是我们用户体验中常说的做好用户研究,明确用户的需求,用户的需求不只是用户怎么说,更重要的是要去观察他在现实中是怎么做的。可能一个用户会告诉你他绝对不会将设备的备用电池插错,但是在实际观察中,我们可能看到这个用户一边和同事聊天,一边操作时,很有可能就犯了这个错误。
2. 观察用户,发现未预期的使用错误。通过对用户模拟操作的观察,发现潜在的界面设计隐患,为界面改进提供数据支持。
3. 设计用户界面,促进设备使用的安全性和有效性。根据观察发现到的问题,使用防止使用相关风险的手段,解决这些问题。
4. 开展可用性评估,证明设计安全性。一般会要求厂家需要招募一定数目的真实用户,在模拟的使用环境下,完成一些有风险的模拟使用,以证明设备在使用过程中相关风险都在可接受范围内,且不会出现厂商没有预计到的风险。
5. 记录可用性过程。要求厂商通过文档的方式,保证人因工程的可追溯性。
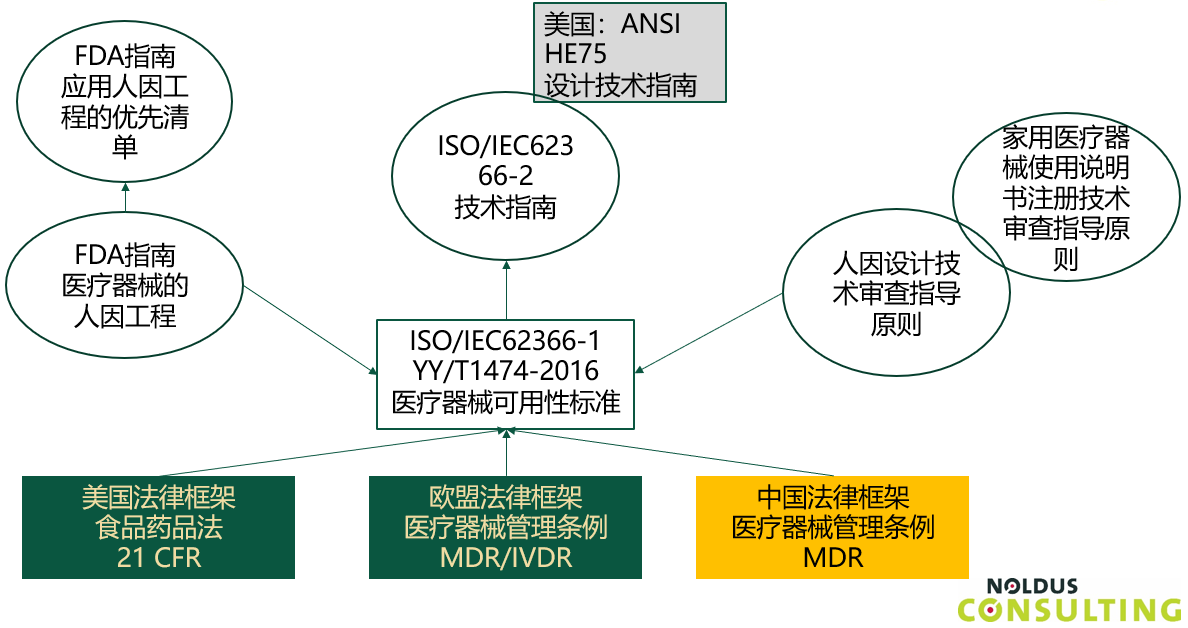
医疗器械可用性的相关法律框架
纵观医疗器械可用性的相关法规要求,我们都能看到有一个国际标准IEC62366-1能够很好的满足多个国家和地区的要求。
包括欧盟的新规定MDR中也出现了很多对可用性工程的要求,比如新增的设备缺陷的解释,就包含了使用错误,也就是说从法律层面上说明了,设备界面设计缺陷导致的医务人员操作错误,是算作设备本身的缺陷了。
而美国CFR820.30中对设计控制的要求里也明确提出,要求设计确认环节“需要在提前定义好的操作情况下进行,确保设备符合用户需求和目标用途,需要包含设备单元在真实/模拟使用情景下的产品测试。”
我国NMPA审评中心在2020年5月份也发布了相关的“人因设计技术审查指导原则征求意见稿”明确提出高使用风险的医疗器械,注册时需要提交“人因设计研究报告”,而这报告当中就要求企业要开展至少15个用户的总结性可用性测试。
可用性过程
前文中也提到了,可用性工程已经被证明能够帮助医疗器械设计厂商改善使用相关的界面问题,并且各国也相继出台了自己的一些相关标准,指导厂家开展具体的工作,各国的相关标准细节上虽有一些差异,但总体上流程是一致的,包含的用户洞察、设计迭代、总结性评估三个阶段。下面就以我国出台的“人因设计技术审查指导原则征求意见稿”作为示例,对可用性的流程进行说明。
医疗器械可用性工程,也作为医疗器械风险管理的工具,与风险管理密不可分。不论是从与使用风向相关的用户界面特征的识别,到识别使用相关的危险和危险情况,再到识别危险产生的使用场景,都离不开可用性过程。在最后风险分析中,确定是否有剩余的使用风险也需要总结性的可用性评估。而反过来风险分析中得到的使用相关的风险分析,也作为整个可用性工程开始的输入,保证了整个过程的可追溯性。
医疗器械可用性关注的人机界面包含了四个主要内容,设备的物理用户界面、软件用户界面、使用和培训指南、标识。因此可用性的流程需要考虑到这四方面的所有内容。
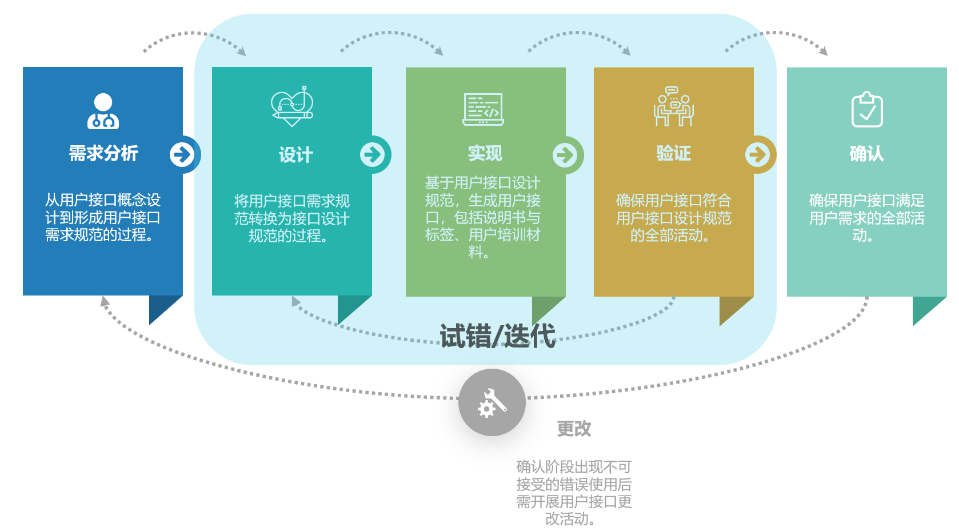
“人因设计技术审查指导原则征求意见稿”中提出的可用性六步
可用性流程的第一步和其他产品的用户体验设计一样,首先要做好需求分析,需要了解到是谁,在什么样的场景下,如何使用该医疗器械。常用的方法有情景化访谈,行为观察等,了解用户在使用现有产品,或者现有解决方案的时候遇到的问题,可能存在的风险等。

不同类型的用户生理能力有差异
比如要制作一款便携式的治疗设备,我们在开展用户需求调查的时候可能发现,现有设备对治疗开始和结束给到用户的反馈不是那么明确,那这个时候我们就产生了一个用户需求,病人需要能够实时查看治疗的进度。
接下来要将用户的需求转化为用户界面的的设计规范,比如设计上要求设备开始治疗时指示灯要变绿,同时提供震动反馈,治疗期间显示进度条等等。
有了设计规范,就能根据要求做出实际的用户界面以用于之后的验证测试。
当做出实际的用户界面,就可以开展形成性的可用性测试,用以验证界面是否能有效的满足最初的设计规范。
通过形成性的可用性测试,确定哪种设计能解决用户需求
设计、实现和验证环节是一个循环往复的过程,厂商需要在这个阶段尽可能的进行试错和迭代,找到满足用户需求的最佳设计方案。尽量让设计当中的问题在设计早期暴露出来。
通过反复的迭代,测试后,用户界面中已经没有新增的未解决的问题后,就可以开展确认活动,即总结性的可用性测试。通过招募15名真实的用户,模拟真实的使用,证明用户界面的安全性和可用性。
如果总结性可用性测试依然发现有不可接受的使用风险,则需要开展人因工程的更改活动。
诺达思方法
诺达思在多年帮助医疗器械厂商,开展可用性工程流程中也结合自身的优势,总结出一套独特的方法,从场景、工具、流程三个方面助力企业完成医疗器械可用性从0到1的突破。
在测试的场景上,可用性流程要求厂商需要在模拟的环境中进行使用测试,测试期间相应的利益相关者还需要能够客观的观察到用户的真实使用过程,因此这就要求我们在尽量还原真实使用环境的同时,还能够将整个操作过程同步记录下来,并且允许相关人员在不影响测试的情况下参与观看。
诺达思根据自身在行为学研究和用户体验领域三十多年的经验,提出了医疗器械可用性实验室的建设方案,物理空间上包含了模拟用户使用环境的测试室和观察用户操作的控制室。控制室可以通过一个单向透光的玻璃观察测试室里用户的真实操作,也可以使用测试室周围的音视频录制设备记录测试的完整过程。

医疗器械可用性实验室示例
测试室主要用于创造使用医疗器械时的真实使用环境,以保证测试过程的生态效度。测试室一般在保证可用性测试能够顺利进行的情况下,尽量还原用户的真实使用环境:手术室,ICU,普通病房,检验室,护士站,紧急救护环境,居家环境等。除包含真实场景外,观察室还装备便于记录和分析用户行为的一系列软硬件,如视频采集设备,音频采集设备,指令接收设备等。
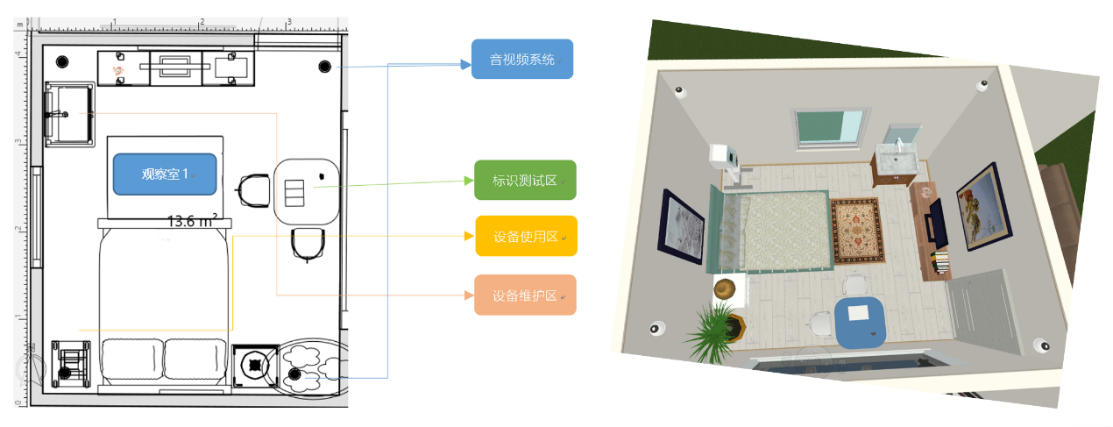
医疗器械可用性实验室——测试室
控制室主要用于可用性测试期间,在不干扰用户的情况下,观察用户的使用行为,并通过医疗器械可用性测试系统,记录标记用户的行为。
控制室主要包含单向玻璃,和全方位监控显示器,医疗器械可用性测试系统,测试过程展示系统。

医疗器械可用性实验室——控制室
在测试用的工具上,诺达思拥有荷兰总部全自主开发的行为观察分析系统,能够帮助医疗器械厂商记录用户操作的完整过程,该系统在行业内被学术期刊引用次数最多,受到广大学术研究者及企业的认可,能帮助用户识别操作错误、操作险肇、使用困难等核心指标,为可用性测试提供可追溯的数据支持。

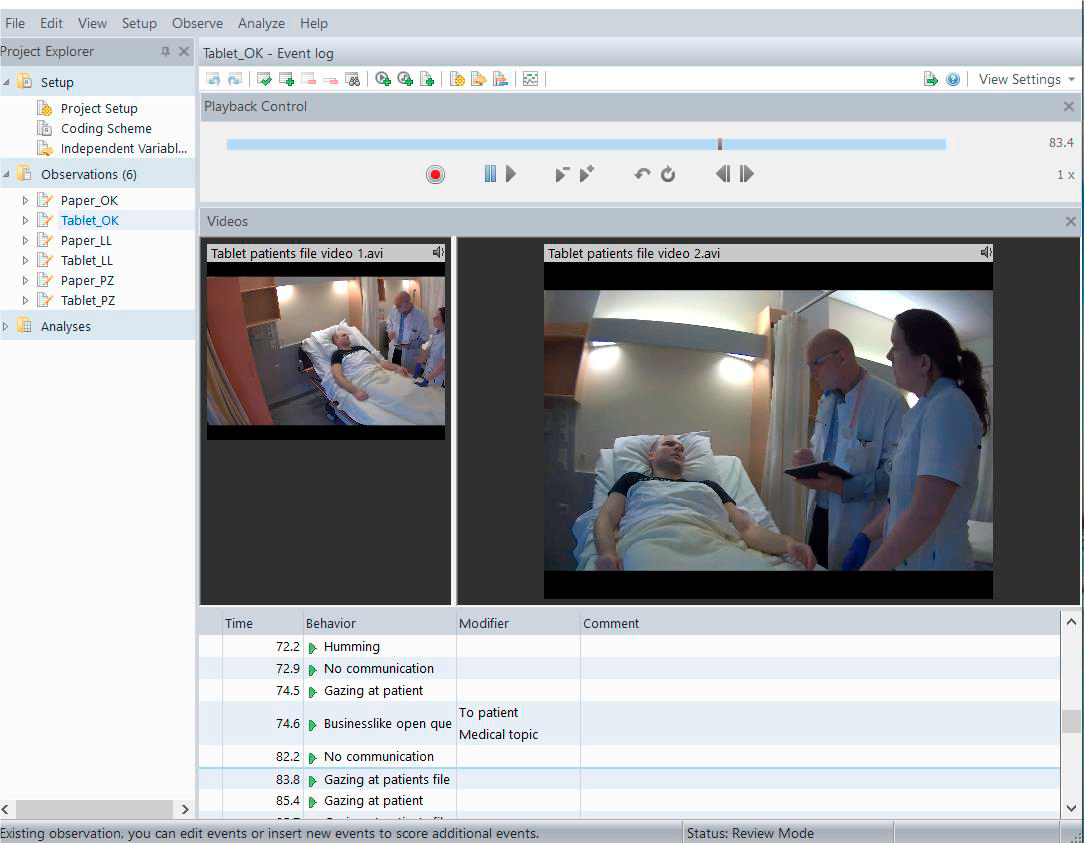
行为观察分析软件视图
行为观察软件输出结果呈现
行为观察软件还能同步调用眼动仪、手指轨迹分析系统、面部表情分析系统、脑电设备、电生理记录设备等市面上主流的用户体验研究工具,同步记录测试的整个完整过程,以更加丰富的指标说明医疗器械界面的使用体验。
同时,诺达思也打造了专业的咨询服务团队,团队成员均具有心理学、社会学等相关专业背景,且至少在可用性工程领域拥有三年以上的相关项目执行经验。为医疗器械厂商提供了课程培训、用户需求研究、形成性测试、总结性测试等全方位的服务。


诺达思咨询人员在完成某医疗器械的总结性可用性测试
行业展望
在诺达思的支持和帮助下,已经有多家国内外企业完成了医疗器械可用性流程从无到有的建设工作,为医疗器械的安全使用提供了产品质量上的保障。相信随着国家相关指导原则的正式出台,国内的医疗器械厂商对于产品可用性以及用户体验会越来越重视,好的界面设计不仅仅是能让使用的医务工作者用起来更舒服,更加能在关键的时候,确保医务人员,不会由于一些小小的过失,造成无法弥补的错误,使得整个医疗器械使用安全更上一个台阶。


