非编码RNA(ncRNA)是一组缺乏蛋白编码的内源RNA,分为小RNA和长链非编码RNA(lncRNA)。之前的研究多关注蛋白编码基因,对ncRNA功能知之甚少,甚至称其为转录“噪音”。然而,近年来的研究发现,ncRNA在多个生物学过程中起着重要的作用。自ncRNA概念提出以来,该领域就成为研究热点,而关于长链非编码RNA(lncRNA)的研究则是ncRNA研究的重点,相关的研究文章也在近年呈现爆发性的增长。下面就一起浏览一下近期都有哪些相关的报道吧:
往期内容回顾:
Science:干扰素非依赖性lncRNA通过调节细胞代谢来促进病毒复制
病毒调节宿主代谢网络以改善其生存。对病毒感染起反应并调节这种代谢变化的分子几乎是未知的,但对于理解病毒感染是必不可少的。本研究中,北京协和医学院的研究人员发现了由多种病毒诱导而不是由I型干扰素(IFN-I)诱导的长链非编码RNA(lncRNA),促进了小鼠和人类细胞中的病毒复制。
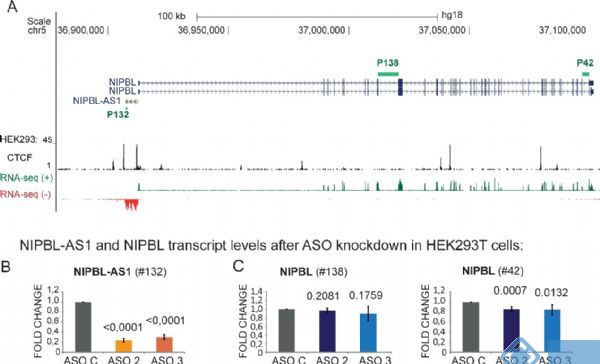
lncRNA-ACOD1(由其最接近的编码基因Acod1鉴定的lncRNA,顺乌头酸脱羧酶1)的体内缺陷通过IFN-I-IRF3(干扰素调节因子3)-独立途径显著减弱病毒感染。细胞质lncRNA-ACOD1直接结合底物生态位附近的代谢酶谷氨酸-草酰乙酸转氨酶(GOT2),增强其催化活性。重组GOT2蛋白及其代谢产物能够在lncRNA-ACOD1缺陷时恢复病毒复制并增加致死率。这项工作揭示病毒诱导的lncRNA介导的代谢促进病毒感染的反馈机制并开发广泛的抗病毒治疗的潜在目标。
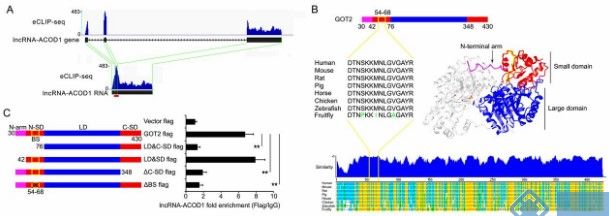
图 lncRNA-ACOD1通过GOT2催化的代谢物促进GOT2的酶活性和功能
Cell Physiol Biochem :lncRNA linc00152在pan-cancer中起到肿瘤推进剂的作用

本研究中哈尔滨医科大学中研究人员对33例乳腺癌样本进行RNA-Seq检测,采用qPCR方法对50例乳腺癌组织和癌旁正常组织进行linc00152表达的检测。该结果与pan-cancer中linc00152的表达结合通过Gene Expression Omnibus和The Cancer Genome Atlas data重新验证。接下来,还评估了体外和体内linc00152的预后,化疗耐药,基因组和表观遗传调控(包括DNA甲基化和组蛋白修饰,潜在生物学功能富集以及pan-cancer基本分子功能)方面的致癌作用。
Linc00152在pan-cancer中特别是在进展期癌症中上调,而linc00152的高表达可能导致pan-cancer患者的预后和化疗耐药性较差。扩增,DNA低甲基化,启动子样lncRNA特征和超级增强子调节是导致pan-cancer中linc00152上调的驱动因素。同时,利用TCGA数据对linc00152进行了富集分析,发现其涉及癌症相关途径,感染和免疫应答相关途径。最后,linc00152被证实能够促进MDA-MB-231,SGC-7901和786-O的增殖,迁移和侵袭。此外,RIP和RNA pull-down试验表明linc00152可以直接与EZH2结合。
这些结果表明linc00152作为一种致癌推进剂从不同的角度来看,可能是pan-cancer的有效治疗靶点。
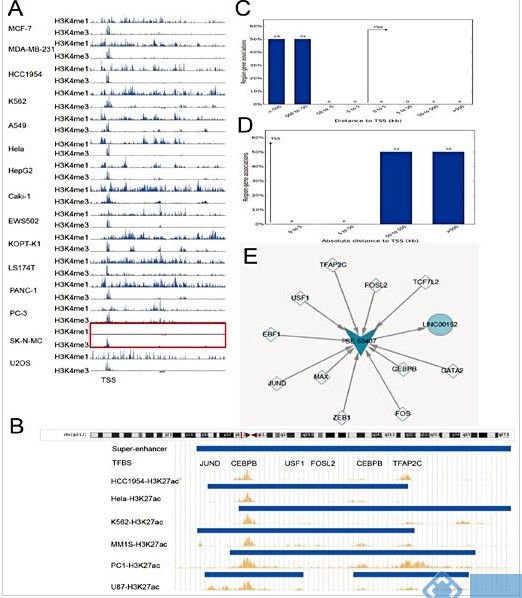
图 Linc00152和启动子/超级增强子调控
Trends Cell Biol:癌症中的lncRNA
长链非编码RNA(lncRNAs)是由人类基因组中一个庞大而又研究较少的区域编码,缺少驱动癌症的因素;近来作为癌症细胞调控的潜在关键因素而备受研究者们的关注。lncRNA在许多癌症中异常表达,它们在促进和维持肿瘤的发生和发展中发挥着关键作用,表明它们作为生物标志物和治疗靶标的临床潜力。
最近的研究揭示lncRNA通过与蛋白质,RNA和脂质相互作用而在癌症信号传导途径中起到关键的信号转导介质的作用。本研究中,美国安德森癌症中心的研究人员回顾了lncRNA调节细胞对细胞外信号反应的机制,并讨论了它们作为诊断指标,分层标记和组合治疗的临床潜力。
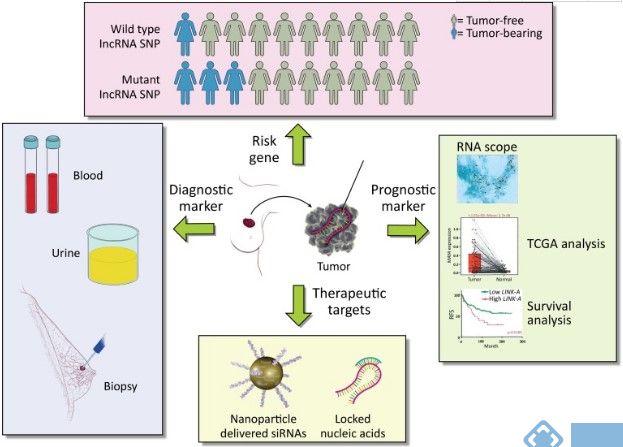
图 lncRNAs作为乳腺癌风险基因,诊断标志物,预后标志物和治疗靶点的价值
The Plant Journal:水稻中lncRNA的多聚腺苷酸化应激反应调控
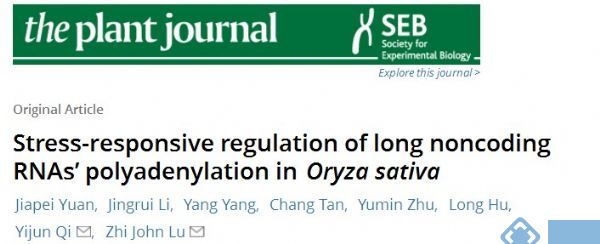
长非编码RNAs(lncRNAs)已被证明参与植物的许多生物过程。然而,缺乏对水稻胁迫应答lncRNAs的转录调控,特别是转录后调控的系统研究。研究人员在四种非生物胁迫下(冷、热、干旱和盐)构建了三种类型的RNA文库(poly(A)+、poly(A)-和nuclear RNAs)进行测序。发现了超过7000个lncRNAs,其中近一半被首次确定。值得注意的是,研究人员发现在胁迫条件下,差异表达的约500个poly(A)lncRNAs显著下调,约25%以nonpoly(A)形式上调。而且,数百个聚腺苷酸化(DPA)下调的lncRNAs是高度保守的,显示出显著的核保留性,并且与在胁迫中起作用的蛋白质编码基因共表达。这些DPA lncRNAs在胁迫耐受性或发育的数量性状基因座(QTL)中显著富集,表明它们在水稻生长的各种胁迫下的潜在作用。
本研究还观察到暴露于干旱和盐胁迫下的植物中累积大量的DPA lncRNAs,这与在这些条件下严重减少的RNA 3'端加工因子是一致的。本研究的结果揭示了许多水稻lncRNAs的聚腺苷酸化和亚细胞定位可能在转录后水平被调节。
图 DPAlncRNA对不同应激的反应
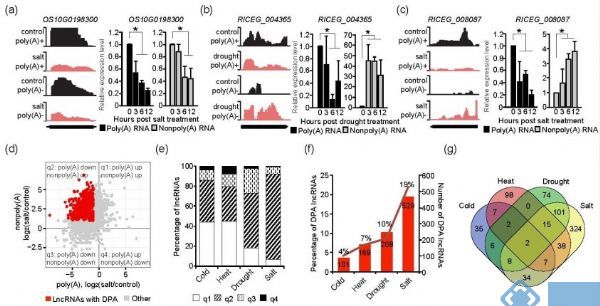
PLoS genetics:内聚负荷因子NIPBL的调节:lncRNA NIPBL-AS1的作用和远端增强子元件的鉴定
黏连蛋白对于基因组稳定性、细胞分裂、转录和染色质组织至关重要的。其功能主要取决于NIPBL(cohesin-loader protein),并在超过60%的狄兰吉氏症候群(CdLS)病例中发现有突变。其他的一些突变在黏连蛋白亚基SMC1A、RAD21、SMC3和HDAC8蛋白中被研究。在25-30%的CdLS病例中,尚未检测到已知CdLS基因的突变。迄今为止,非编码基因组中的功能元件没有在CdLS的分子病因学中被表征,因此被排除在突变筛选之外,尽管此类突变的影响现已被广泛认可。
本研究中鉴定了涉及NIPBL基因调控的非编码基因组的不同元件。NIPBL-AS1是一个由NIPBL上游转录的反义lncRNA。通过敲低和转录阻断实验,可以证明该lncRNA不是NIPBL-AS1基因产物,但其实际转录对于调节NIPBL表达水平十分重要。这揭示了通过干扰NIPBL-AS1 lncRNA来提高NIPBL基因的转录活性的可能。此外,目前已经确定了一种调节NIPBL和NIPBL-AS1的新型远端增强子。在HEK293T细胞中使用CRISPR基因组编辑敲除增强子,降低了NIPBL、NIPBL-AS1的表达,且发现CdLS中的基因失调。
图 NIPBL-AS1不影响NIPBL转录
eLife:一种c-Myc可诱导的lncRNA-LAST与CNBP协同促进人细胞中CCND1 mRNA的稳定性
细胞周期蛋白D1是细胞周期进展中的关键调控因子,作用于G1期到S期的转变。本研究对一种新型的c-Myc调节的lncRNA LAST(LncRNA-Assisted Stabilization ofTranscripts)进行了分离与鉴定,它可以作为一种CCND1 mRNA稳定剂。LAST与CNBP协同作用结合到CCND1mRNA的5'UTR。从CNBP RIP-seq和LAST RNA-seq的数据显示,CCND1 mRNA可能不是LAST和CNBP的唯一靶标;另外还有三种mRNAs是LAST和CNBP的转录后靶标。在异种移植模型中,LAST的消耗减少并且LAST的异位表达诱导肿瘤形成,这提示其具有致癌功能。
本研究报告了一种先前未知的lncRNA,其涉及参与CCND1 mRNA稳定性的精细调节;缺乏该lncRNA,CCND1将表现出部分表达的情况。
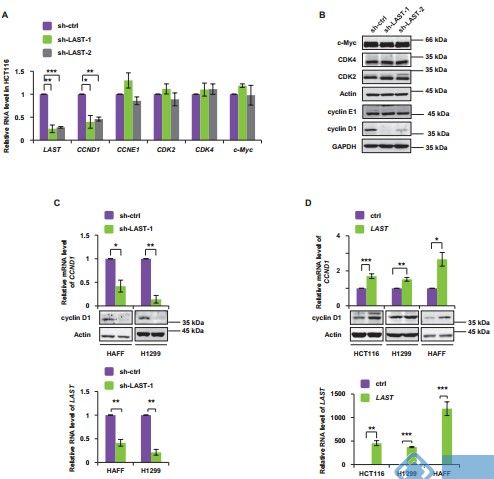
图 LAST加速G1/S期转换并上调cyclin D1 / CCND1
参考文献
1.Wang P, Xu J, Wang Y, Cao X. (2017) Aninterferon-independent lncRNA promotes viral replication by modulating cellularmetabolism. Science 358(6366):1051-1055.
2.Xu S, Wan L, Yin H, Xu H, Zheng W, Shen M,Zhang Z, Pang D. (2017) Long Noncoding RNA Linc00152 Functions as a TumorPropellant in Pan-Cancer. Cell Physiol Biochem 44(6):2476-2490.
3.Lin C, Yang L. (2017) LongNoncoding RNA in Cancer: Wiring Signaling Circuitry. TrendsCell Biol.
4.Yuan J, Li J, Yang Y, et al.Stress‐responsive regulation of long noncoding RNAs’ polyadenylation in Oryzasativa[J]. The Plant Journal.
5.Zuin J, Casa V, Pozojevic J, et al.Regulation of the cohesin-loading factor NIPBL: Role of the lncRNA NIPBL-AS1and identification of a distal enhancer element[J]. PLoS genetics, 2017,13(12): e1007137.
6.Cao L, Zhang P, Li J, et al. LAST, ac-Myc-inducible long noncoding RNA, cooperates with CNBP to promote CCND1 mRNAstability in human cells[J]. eLife, 2017, 6.