
发表期刊:Journal of Extracellular Vesicles
发表时间:2021年2月23日
样本类型:小鼠缺血—再灌注(IR)心脏外泌体
研究方法:外泌体miRNA测序、RT-qPCR
文章链接:Myocardial ischemia-reperfusion induced cardiac extracellular vesicles harbour proinflammatory features and aggravate heart injury
急性心肌梗死是一个发病率和死亡率较高的全球性问题。快速恢复冠状动脉血流是减少心肌梗死和改善心功能的最有效策略。然而,再灌注会导致不可逆的心肌损伤,被称为心肌缺血-再灌注(IR)损伤。目前,IR损伤的机制尚不明确,仍缺乏有效的治疗方法。炎症是维持体内平衡的基本生物学过程,但过度的炎症反应会导致组织损伤。巨噬细胞是心肌梗死触发的炎症级联反应的重要效应因子和调节因子,其中M1型巨噬细胞是促炎类型,在促炎细胞细胞因子的吞噬和分泌中起重要作用。细胞外囊泡(EVs)是一种具有双层脂膜的细胞来源的纳米级囊泡,越来越多的证据证实了EVs作为细胞间通信载体的重要作用。最近的研究揭示了EVs在炎症调节中的功能,并证实了EVs通过调节巨噬细胞的极化参与各种疾病的发展,然而IR诱导的EVs作用仍然有待披露。大量研究表明非编码RNA在心血管疾病中发挥重要作用,特别是miRNA。心脏IR-EVs和EVs传递的miRNA是否以及如何在IR损伤中发挥其作用,目前尚不清楚。
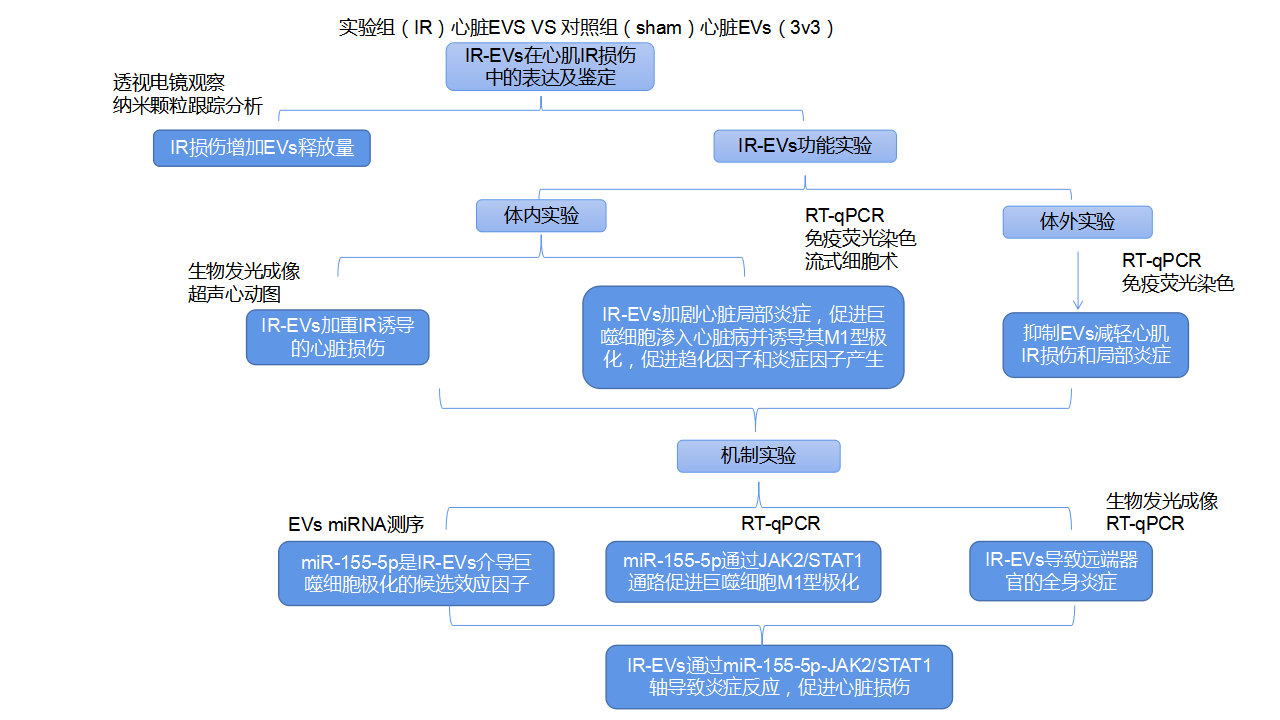
通过透射电镜观察来自对照组与IR损伤心脏的EVs,典型的四种外泌体标记物CD63、CD9、Alix和TSG101在两组中均表达,IR损伤增加了EVs的释放量,并没有显著调节EVs的大小。
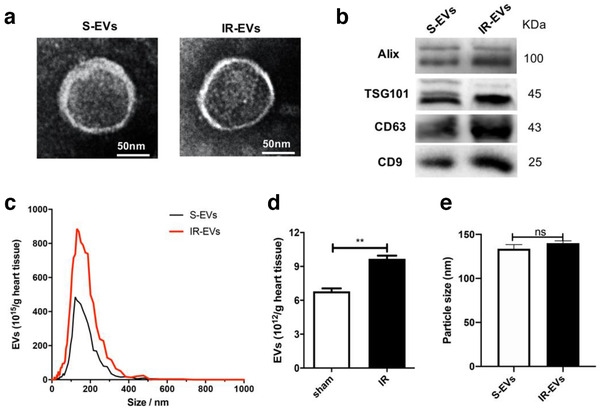
2、IR-EVs加重了IR诱导的心脏损伤,促进IR损伤心脏中巨噬细胞的M1型极化
为了进一步阐明IR-EVs在心脏IR损伤中的作用,将IR-EVs用DiR标记后注射到sham组与IR损伤组心脏中。生物发光成像结果显示,IR-EVs在注射后24h可保留在心脏内与注射PBS的组相比,IR-EVs显著损害心脏功能,增加梗死面积。说明IR-EVs会加重IR诱导的心脏损伤。
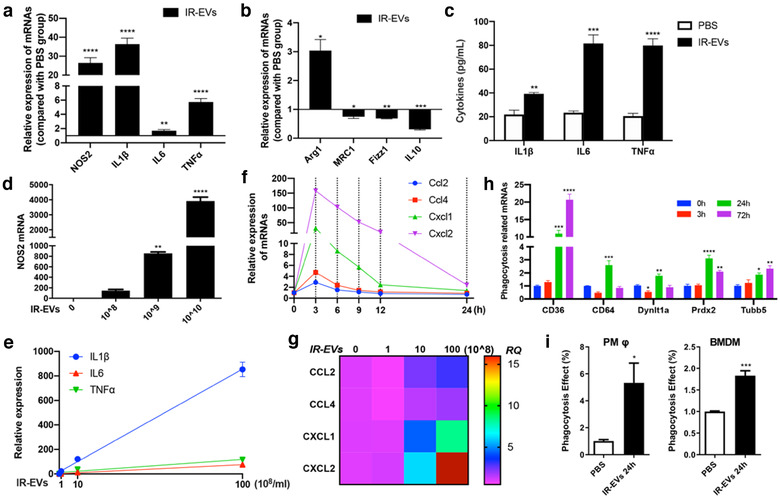
巨噬细胞极化在IR诱导的心脏损伤和修复中起重要作用。因此研究人员试图确定IR-EVs是否调节巨噬细胞极化。结果显示,IR-EVs显著增强IR损伤心脏中M1极化标记基因NOS2和促炎细胞因子IL1β、IL6和TNFα表达,而与M2极化相关的Arg1、MRC1、Fizz1和IL10的mRNA水平则大幅下降。增强了IR损伤小鼠心脏和循环白细胞中Ccl2、Ccl4、Cxcl4、Cxcl1和Cxcl2的表达,降低IR损伤小鼠循环白细胞中IL10表达。心脏组织免疫荧光染色实验显示IR-EV输血促进了CD45+炎症细胞和CD45+F4/80+巨噬细胞的浸润。流式细胞术进一步证实了IR-EVs能够加剧局部炎症,促进巨噬细胞渗入损伤心脏,并促进其M1型极化。
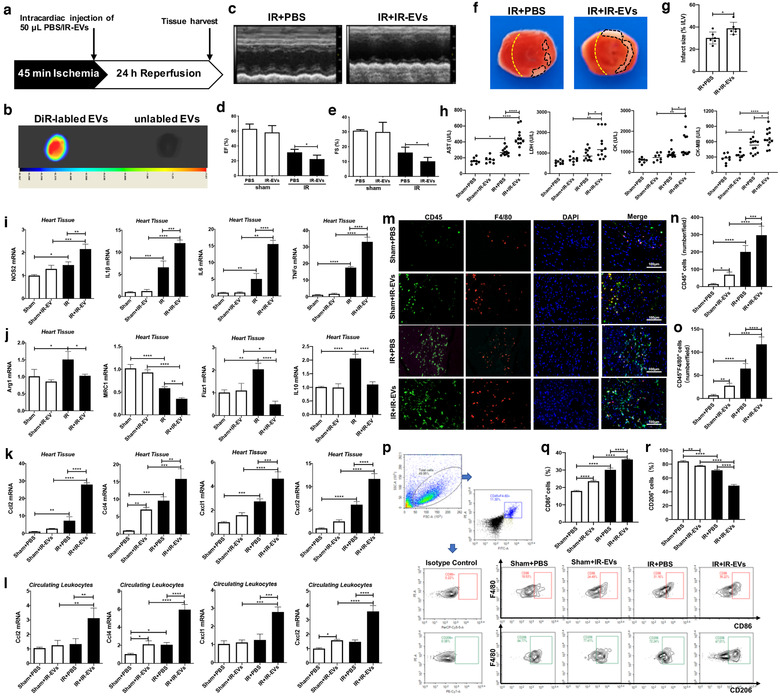
3、抑制EVs的产生可减轻心肌IR损伤,减轻局部炎症
研究人员使用GW4869(外泌体抑制剂)探索抑制EVs对IR诱导的心肌损伤的影响。结果显示,注射GW4869处理能够显著改善了IR损伤小鼠的心脏功能,减少梗死面积,降低心肌酶水平,并且抑制了NOS2、IL1β、IL6和TNFα的表达。与IR小鼠相比,GW4869处理的IR小鼠心脏中促炎趋化因子Ccl2、Ccl4、Cxcl1和Cxcl2的表达减少,并且减少了IR损伤心脏中CD45+炎症细胞和CD45+F4/80+巨噬细胞的浸润。GW4869抑制IR-EVs对心脏的保护作用进一步表明IR诱导的EVs参与心脏IR损伤,促进炎症反应增强。
4、IR-EVs可在体外编程巨噬细胞M1型极化
为了进一步阐明IR-EVs对巨噬细胞极化的作用,研究人员用原代腹腔巨噬细胞和IR-EVs进行体外共培养。结果表明,IR-EVs能够促进M1型极化相关基因NOS2、IL1β、IL6和TNFα的表达,并且表达水平随着IR-EVs浓度的增加而增加。降低M2型极化相关基因MRC1、Fizz1和IL10的表达,提高促炎因子IL1β、IL6和TNFα的蛋白水平,并且趋化因子Ccl2、Ccl4、Cxcl1和Cxcl2的mRNA表达水平也显著升高。实验结果表明,IR后大量IR-EVs的释放可能是促进趋化因子和炎症因子产生的因素之一。此外,IR-EVs处理显著提高了吞噬相关基因的表达,并促进了腹腔巨噬细胞PMφ和骨髓源性巨噬细胞BMDMs的吞噬活性。
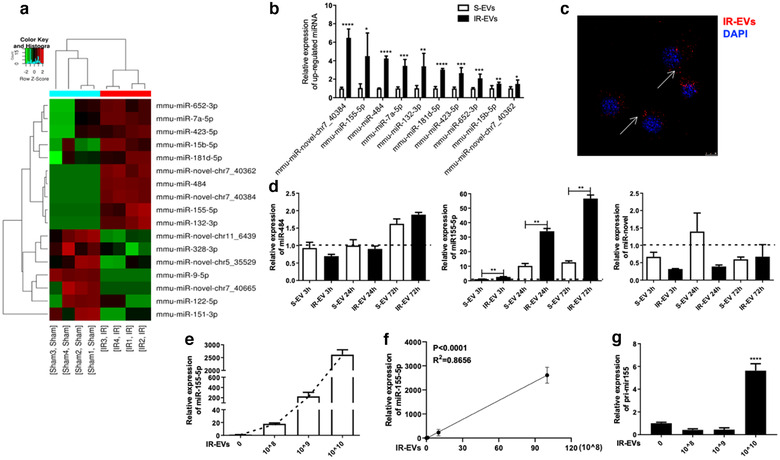
5、MiR-155-5p是IR-EVs介导巨噬细胞极化的候选效应因子
EVs通过传递miRNA而被称为细胞间的通信载体。因此,研究人员对来自sham和IR组的心脏EVs进行miRNA测序(3v3),来确定候选miRNA效应因子。鉴定获得的差异表达的miRNAs,并对在IR-EVs中前十个高表达的miRNA进行qPCR验证。
共聚焦显微镜结果显示,IR-EVs可以被巨噬细胞摄取。为了进一步确定候选miRNA,在与IR-EVs共培养的PMφ中检测高表达前三的miRNA。与S-EVs共培养的巨噬细胞相比,与IR-EVs共培养的PMφ中miR-155-5p表达量显著上调,并且miR-155-5p表达量与IR-EVs呈正相关。因此,推测miR-155-5p可能是IR-EVs中具有关键作用的候选效应因子。
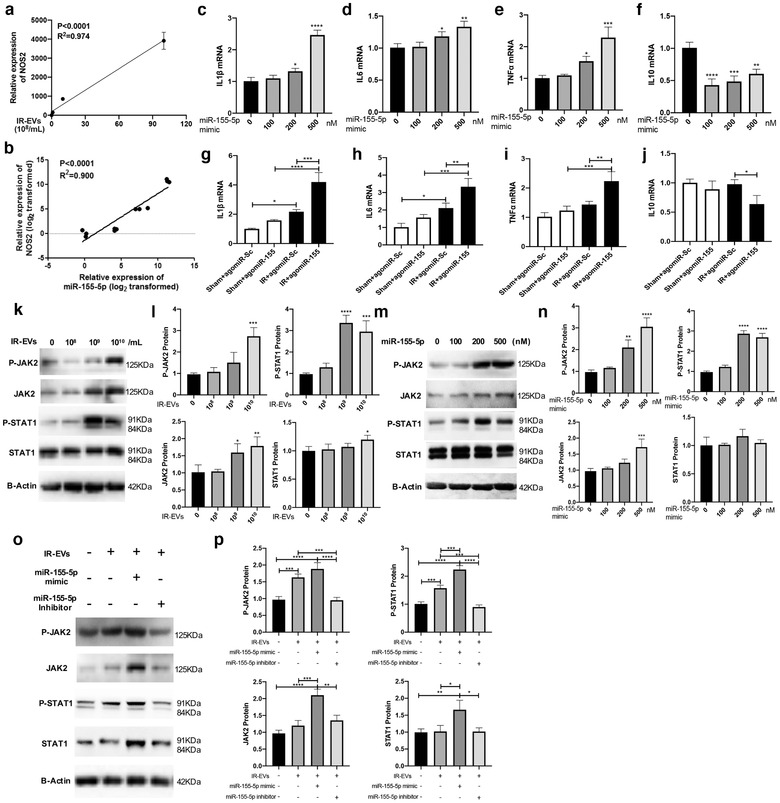
6、IR-EVs中miR-155-5p通过IAK2/STAT1通路促进巨噬细胞M1型极化
在与IR-EVs共培养的巨噬细胞中,研究人员证实了IR-EVs浓度和NOS2表达正相关,miR-155-5p表达和NOS2表达正相关。转染miR-155-5p 模拟物能增加促炎因子表达,降低抗炎细胞因子IL10表达。此外,心脏内给药agomiR-155能够重现IR-EVs促炎作用,IL1β、IL6和TNFα表达增加,IL10表达降低。
已有研究表明,JAK/STAT1是巨噬细胞M1型极化的重要调控通路。IR-EVs能够显著提高PMφ中总JAK2和磷酸化JAK2的表达下游分子STAT1也被激活。在巨噬细胞中加入miR-155-5p模拟物也同样激活了JAK2/STAT1通路。并且miR-155-5p模拟物能进一步增强IR-EVs诱导的JAK2/STAT1激活作用。miR-155-5p抑制剂会抑制巨噬细胞中p-JAK2和p-STAT1蛋白升高。这些实验结果都表明了miR-155-5p通过激活JAK2/STAT1参与IR-EVs调控的巨噬细胞M1型极化。
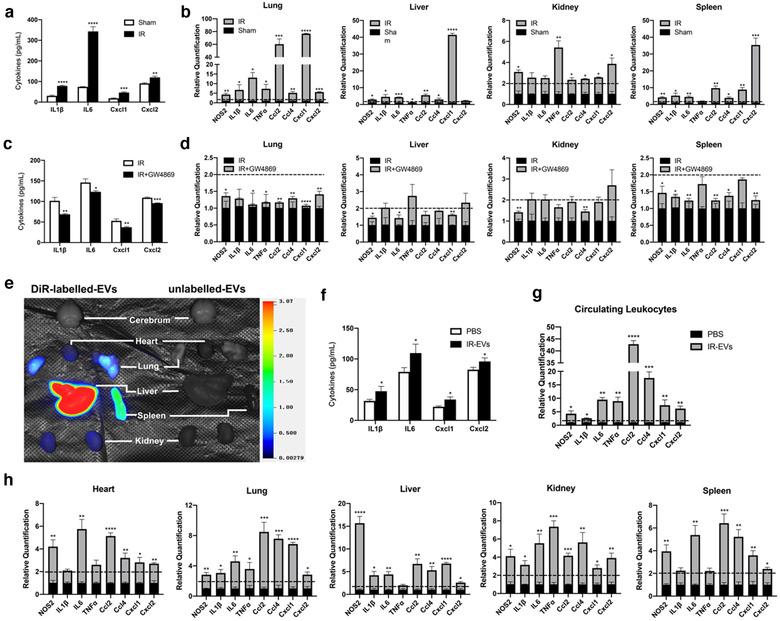
7、IR-EVs能够导致远端器官的全身炎症
前期实验已经表明IR-EVs能够导致心脏的局部炎症,那么IR-EVs是否在其他器官中发挥作用?研究人员证实了心肌IR损伤触发了循环中EVs释放增加,IR损伤促进循环中促炎细胞因子(IL1β和IL6)和趋化因子(Cxcl1和Cxcl2)的分泌,除了心脏组织,在肺、肝、肾、脾等远处器官中均出现了促炎基因表达增加的情况。GW4869治疗减少了IR损伤小鼠的循环中促炎因子和趋化因子的释放,降低心肌IR诱导的远处器官的促炎基因表达。
生物发光成像显示,对正常小鼠静脉注射DiR标记的IR-EVs24h后,IR-EVs存在于不同器官中,在循环白细胞及各器官中均检测到促炎基因表达升高,并且上调了多个器官中CD45+和CD45+F4/80+细胞的表达。表明IR-EVs在心脏IR损伤期间能够促进全身炎症反应。
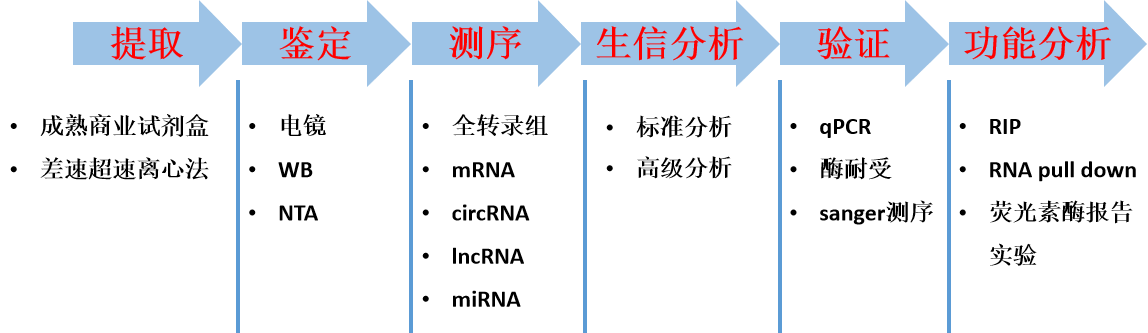
1.一站式服务
客户只需提供细胞上清、血清、血浆、外泌体RNA,云序生物为您完成从外泌体提取、外泌体鉴定、外泌体转录组测序、RIP、RNA pull-down、双荧光素酶报告实验到数据分析整套服务流程。
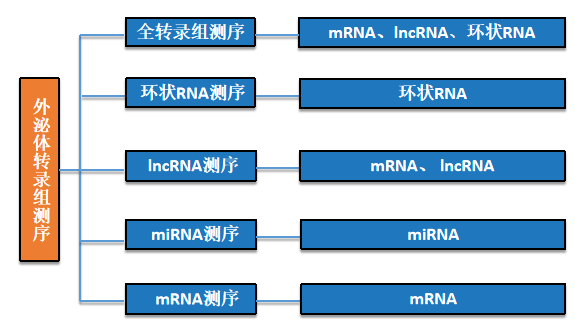
3.丰富的外泌体测序经验
云序生物作为以高通量测序技术为依托的科研服务公司,拥有丰富的微量样本测序经验,为众多临床与基础科研研究者提供了高质量的科研服务,助力客户发表过众多外泌体的SCI文章。
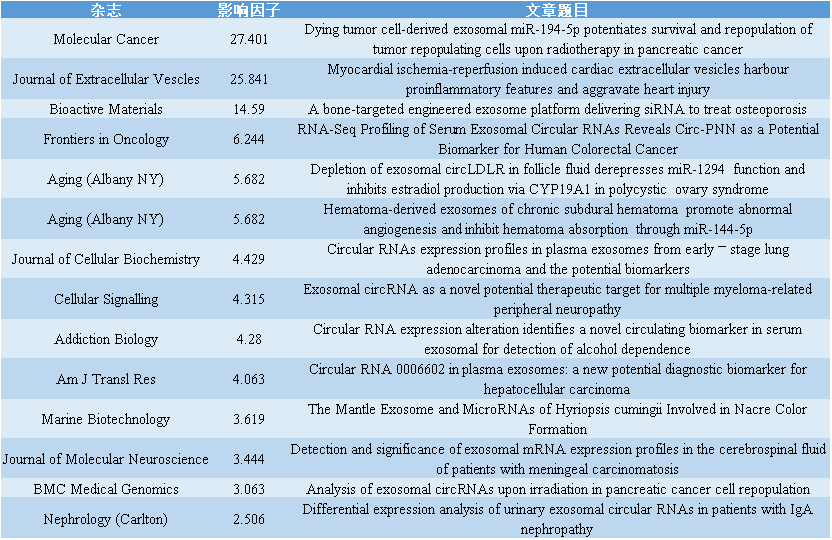
往期外泌体主题回顾

