行为灵活性(Behavioral flexibility)是一种根据不断变化的环境或突发事件作出调整的重要能力,在多数神经精神类疾病如自闭症、精神分裂症、强迫症和迟发性痴呆等疾病中存在,且在衰老过程中也会伴随着灵活性和认知缺陷。然而,衰老过程中行为灵活性受损的潜在机制尚不清楚。
近日,华中科技大学同济医学院基础医学院病理生理学系朱玲强教授团队在Molecular Psychiatry杂志发表研究论文“Social isolation reinforces aging-related behavioral inflexibility by promoting neuronal necroptosis in basolateral amygdala”。研究借助快速老化SAMP8小鼠模型,首次揭示老年行为灵活性障碍的分子机制,发现糖原合酶激酶-3(GSK-3α)调控mTORC1信号通路参与基底外侧杏仁核(basolateral amygdala, BLA)神经元程序性坏死及行为灵活性障碍。同时研究还揭示了目前老年人中普遍存在的生活方式—独居是老年行为灵活性障碍的高危因素,并提出了可能的干预策略。

结果
衰老小鼠BLA神经元活性降低,表现行为灵活性障碍
首先,研究者借助基于气味刺激的反转学习行为学范式测试5月龄快速老化SAMP8小鼠的行为灵活性:小鼠选择气味1时给予食物奖赏,选择气味2时无奖赏,待小鼠的正确选择达到一定标准后,进行反转学习测试,小鼠选择气味1时无奖赏,选择气味2时给予奖赏(图1A,B),结果显示,5月龄SAMP8小鼠在反转学习过程中需要更多次的训练才能达到标准(图1C,D),表现出行为灵活性障碍。此外,在延迟折扣行为范式中,SAMP8小鼠同样表现出类似的症状(图1F,G)。
眶额皮质(orbitofrontal cortex, OFC)、杏仁核(amygdala)和后梨状皮层(posterior piriform cortex, PPC)是基于气味刺激的反转学习的三个重要脑区,同时,伏隔核(nucleus accumbens, NAc)、OFC、内侧前额叶皮层(medial prefrontal cortex, mPFC)和杏仁核参与延迟折扣行为(图1H)。基于此,研究者借助c-fos和Egr1染色发现BLA神经元活性降低,提示了BLA可能参与调节SAMP8小鼠的行为灵活性(图1H-J)。此外,电生理记录结果显示,反转学习过程中,SAMP8小鼠BLA自发局部场电位(local field potential, LFP)中Theta 振荡减弱(图1K-P),提示了BLA神经元活性降低,功能受损。
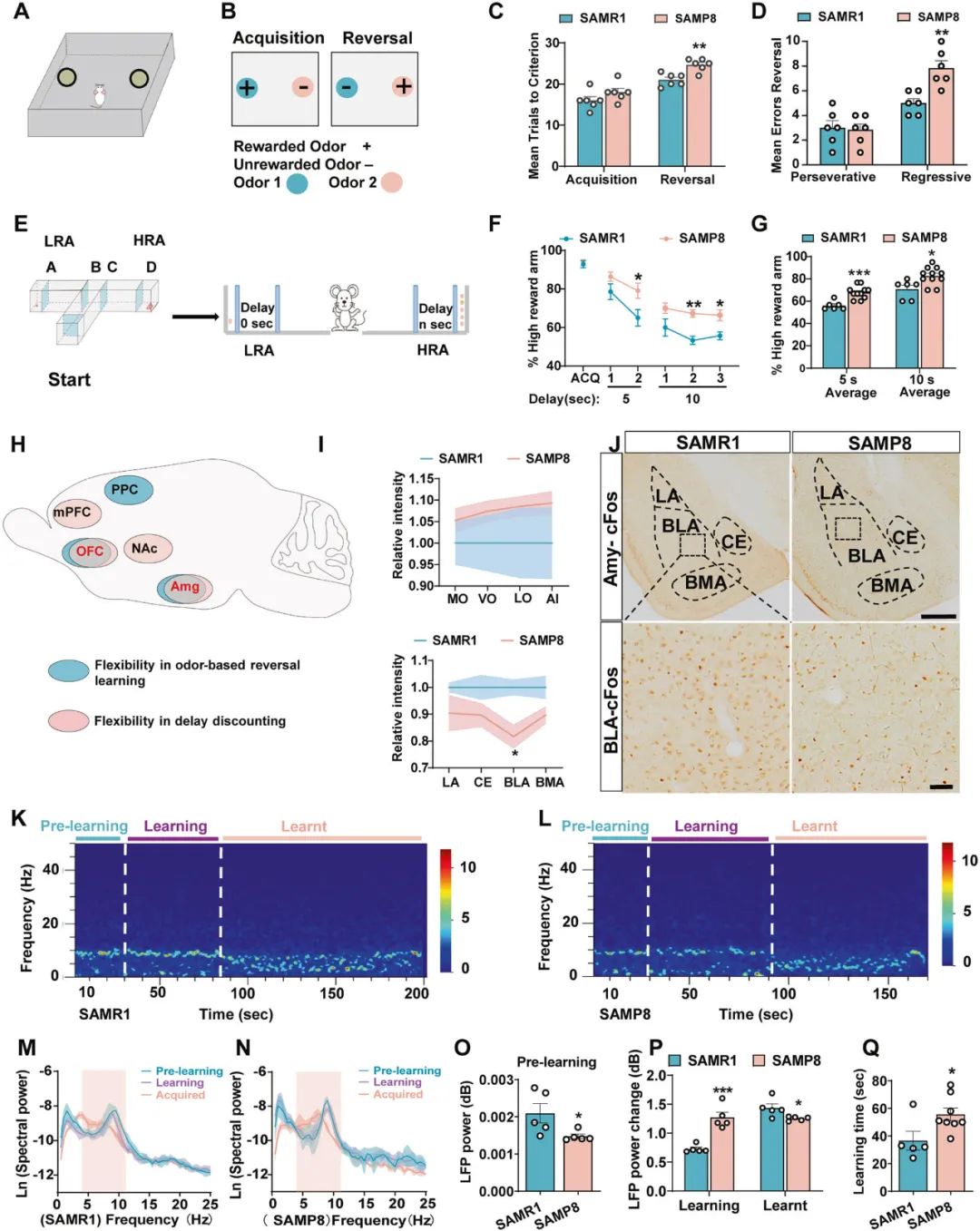
图1 SAMP8小鼠BLA神经元活性降低,表现行为灵活性障碍
BLA神经元程序性坏死参与衰老小鼠行为灵活性障碍
接下来,研究者借助Nissl染色和免疫组化发现,SAMP8小鼠BLA神经元丢失以及突触素(synaptophysin, SYP)表达降低(图2A-C)。有趣的是,老年食蟹猴脑中也发现杏仁核神经元丢失的现象(图2D-F)。
细胞凋亡和细胞坏死是细胞死亡的两种主要模式,研究者发现SAMP8小鼠和SAMR1小鼠(抗快速老化小鼠)的凋亡信号相关蛋白的表达无明显差异,然而,程序性细胞坏死相关信号蛋白RIPK3,pRIPK3,MLKL和pMLKL的表达显著增加(图2G,H),且SAMP8小鼠BLA神经元pMLKL膜转位明显,提示细胞坏死(图2I,J)。通过腹腔注射Nec-1s(选择性坏死性凋亡抑制剂)后,发现可明显改善SAMP8小鼠BLA神经元死亡及行为灵活性障碍(图2M-P)。这些结果提示了程序性细胞坏死参与老年小鼠的神经元死亡及行为灵活性障碍。
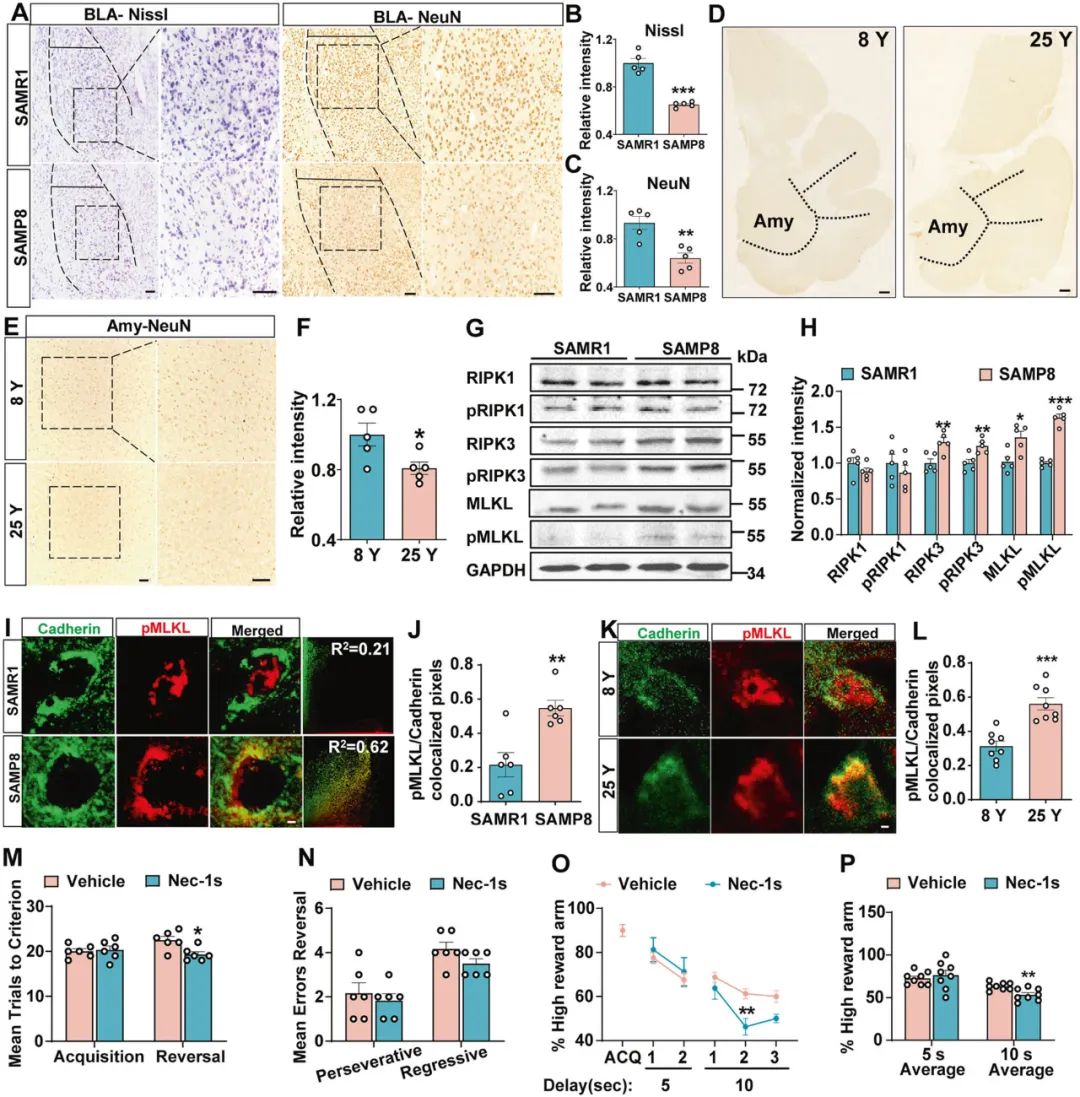
图2 BLA神经元程序性坏死参与老年小鼠行为灵活性障碍
GSK-3α调控mTORC1信号通路参与衰老小鼠行为灵活性障碍
基于上述结果,研究者进一步研究介导老年小鼠BLA神经元坏死的潜在分子机制。借助mRNA微阵列(mRNA microarrays) 发现SAMP8小鼠中存在8个基因显著下调(图3A),其中GSK-3α(糖原合酶激酶-3)是仅有一个被报道参与衰老和细胞死亡相关的基因,且在SAMPA8小鼠和老年食蟹猴杏仁核中GSK-3α表达水平明显降低(图3B-I),且BLA中GSK-3α的表达下调与pMLKL膜转位高度相关(图3J-N)。这些结果提示了GSK-3α的表达下调参与老年动物BLA神经元坏死。
随后,研究者验证GSK-3α与神经元坏死之间的因果关系,在GSK-3αflox/+鼠BLA注射AAV2/8- hSyn-Cre病毒,条件性敲除小鼠BLA神经元中GSK-3α基因(GSK-3α+/−,图3O-Q),结果显示,GSK-3α+/−小鼠BLA中RIPK3、pRIPK3、MLKL和pMLKL的表达水平显著增加,同时表现出行为灵活性障碍(图3R-Y)。这些结果提示了衰老小鼠BLA中GSK-3α表达下调可导致神经元坏死和动物行为灵活性障碍。
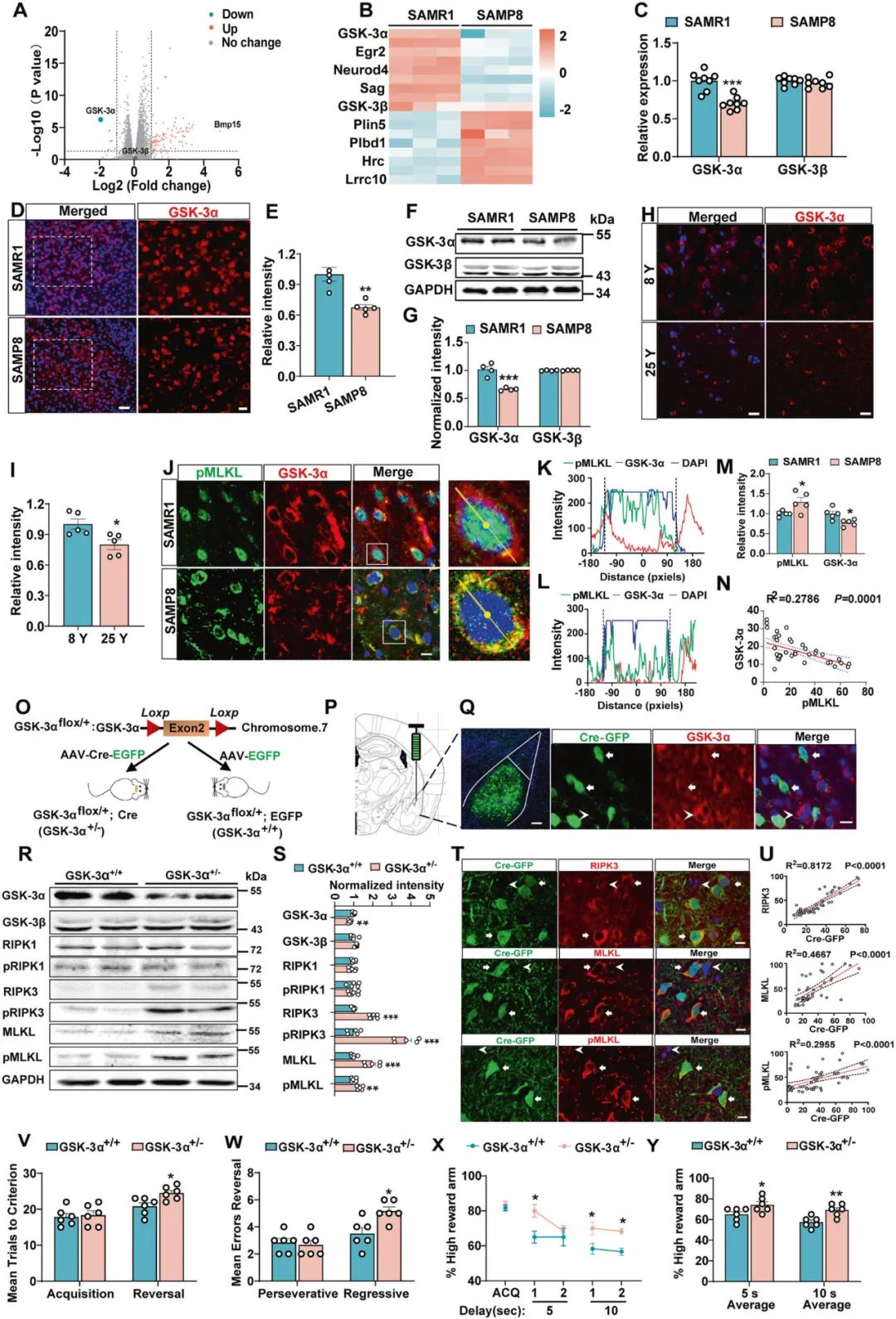
图3 下调BLA中GSK-3α的表达导致衰老小鼠神经元坏死及行为灵活性障碍
进一步,研究者在4月龄SAMP8小鼠BLA中注射AAV2/8-hSyn-GSK-3α病毒,发现BLA神经元中过表达GSK-3α可导致SAMP8小鼠BLA中程序性细胞坏死相关信号蛋白表达水平显著降低,并改善小鼠的行为灵活性障碍(图4A-K)。研究者通过动物和细胞水平发现,下调GSK-3α表达可导致RIPK3蛋白水平及其磷酸化水平显著增加(图4L-N),提示了RIPK3降解受阻可能参与由GSK-3α表达下调诱发的神经元坏死过程。
激活的mTOR信号通路可以通过抑制自噬来减少RIPK3的降解,研究者借助分子生物学手段发现,GSK-3α+/−小鼠和老年SAMP8小鼠BLA中mTORC1信号通路被激活,自噬受损(图4O-S),提示了mTORC1信号通路通过诱发自噬功能障碍参与老年小鼠神经元坏死过程。
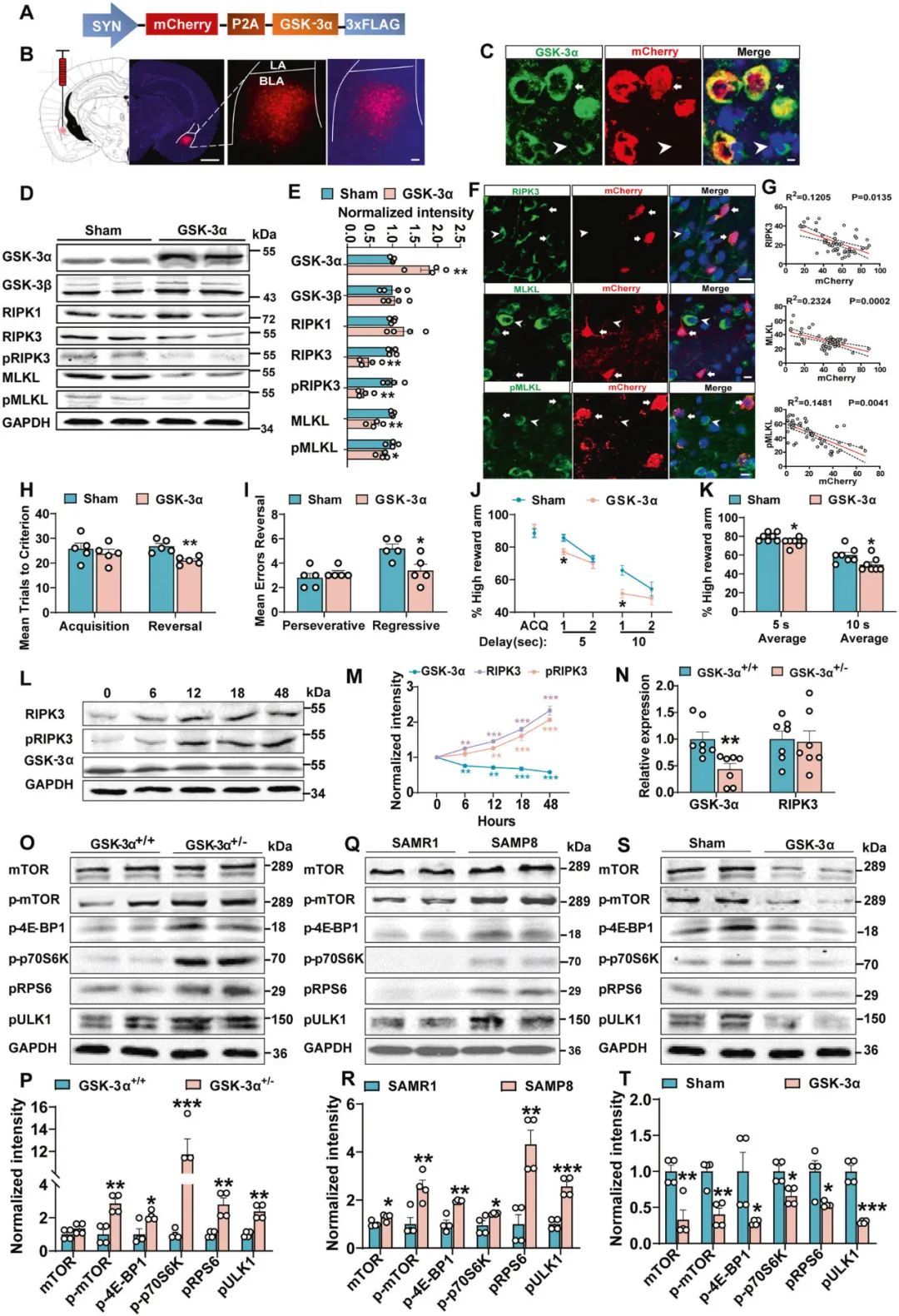
图4 上调GSK-3α的表达改善了SAMP8小鼠BLA神经元程序性坏死及灵活性受损,mTORC1信号通路通过诱发自噬功能障碍参与老年小鼠神经元坏死过程
独居是老年行为灵活性障碍的高危因素
孤独和社交孤立可加剧老年人或老龄动物的认知改变,那么孤独/社交孤立是否会影响老年动物的行为灵活性呢?为解答这一问题,研究者将3月龄SAMP8小鼠分为独居(I-SAMP8)和群居(S-SAMP8)两组,饲养1个月(图5A),结果显示,独居SAMP8小鼠BLA神经元中GSK-3α表达降低、mTORC1信号被激活、程序性细胞坏死相关信号蛋白表达显著增加,导致神经元丢失并表现出行为灵活性障碍(图5B-M)。随后,通过病毒载体过表达GSK-3α后可有效改善小鼠行为灵活性障碍(图5N-R)。这些数据提示了独居作为目前老年人中普遍存在的生活方式,是老年行为灵活性障碍的高危因素。
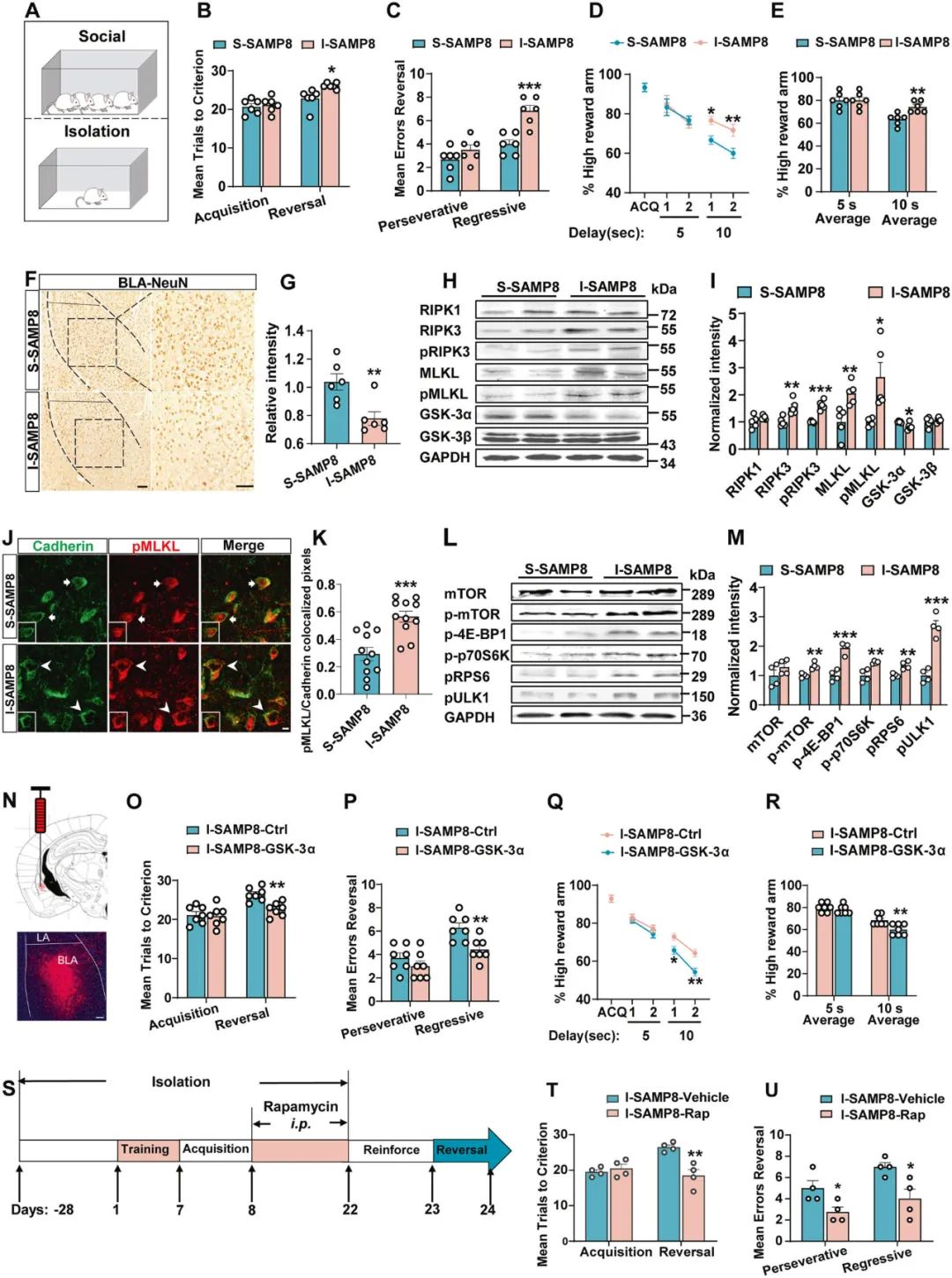
图5 独居是老年行为灵活性障碍的高危因素
结论
本文基于SAMP8快速衰老小鼠,配合行为学、病毒载体介导的基因调控手段、分子生物学等多种技术手段揭示老年行为灵活性障碍的潜在分子机制:BLA神经元中GSK-3α的缺失诱发mTORC1信号通路的激活,从而促进RIPK3依赖性细胞程序性坏死,导致BLA神经元活性降低,引发行为灵活性障碍。同时研究还揭示了目前老年人中普遍存在的生活方式—独居是老年行为灵活性障碍的高危因素,并提出了可能的干预策略。
和元生物有幸为研究者提供实验中使用的AAV和慢病毒载体,助力神经科学研究!
